
Eisensulfat (FeSO4) Struktur, Eigenschaften, Synthese

Das Eisensulfat ist ein anorganisches Salz, dessen chemische Formel FeSO ist4. Es besteht aus einem kristallinen Feststoff mit variabler Farbe, der industriell als Nebenprodukt der Stahlverarbeitung anfällt..
Es kommt in der Natur in verschiedenen Formen vor, am häufigsten ist Eisensulfat-Heptahydrat, FeSO47HzweiO ("grünes Vitriol", im Mineral Melenterit enthalten). Dieses Hydrat ist leicht an der bläulich-grünen Farbe seiner Kristalle zu erkennen (unteres Bild). Andere Hydrate haben die allgemeine Formel FeSO4XHzweiOder wobei x von 1 bis 7 variiert.

Eisensulfat-Heptahydrat verliert beim Erhitzen Wassermoleküle und kann in andere Formen von Eisensulfat umgewandelt werden. Wenn es auf 57 ° C erhitzt wird, verliert es drei Wassermoleküle und wird in Eisensulfat-Tetrahydrat umgewandelt. Wie viele können Sie insgesamt verlieren? Sieben Wassermoleküle, also zu viel Wasser.
Eisensulfat wird zur Behandlung und Vorbeugung von Eisenmangelanämie eingesetzt. Es kann jedoch toxische Wirkungen haben, daher müssen Sie bei der Dosierung vorsichtig sein.
Andererseits hat dieses Eisensalz zahlreiche Verwendungen und Anwendungen, einschließlich der Färbung von Textilmaterial und Leder; chemisches Reduktionsmittel; Strahlungsdosimeter; Holzschutzmittel. Es wird auch zur Vorbeugung von Chlorose in Pflanzen sowie bei Gravur- und Lithographieprozessen eingesetzt..
Das FeSO4 kann in Luft zu Eisen (III) sulfat, Fe oxidierenzwei(SW4)3 mit einer Geschwindigkeit, die durch Temperatur, Licht oder einen Anstieg des pH-Werts erhöht werden kann.
Viele der physikalischen und chemischen Eigenschaften von Eisensulfat, wie die Löslichkeit in Wasser, der Schmelzpunkt, die Art der gebildeten Kristalle und die Dichte, hängen von der Anzahl der in die Kristalle eingebauten Wassermoleküle ab. das heißt, von seinen Hydraten.
Artikelverzeichnis
- 1 Struktur von Eisensulfat
- 1.1 Säure
- 2 Physikalische und chemische Eigenschaften
- 2.1 Namen
- 2.2 Summenformel
- 2.3 Molekulargewicht
- 2.4 Aussehen
- 2.5 Geruch
- 2.6 Dichte
- 2.7 Schmelzpunkt
- 2.8 Löslichkeit in Wasser
- 2.9 Löslichkeit in Alkohol
- 2.10 Dampfdruck
- 2.11 Brechungsindex
- 2.12 Stabilität
- 2.13 Zersetzung
- 2.14 Reaktionen
- 3 Synthese
- 3.1 Aus Stahlwolle
- 3.2 Aus Pyrit
- 4 Risiken
- 5 Verwendungen
- 5.1 In der Landwirtschaft
- 5.2 Als Reagenz und in der Industrie
- 5.3 In der Medizin und zur Anreicherung von Lebensmitteln
- 5.4 Andere
- 6 Referenzen
Struktur von Eisensulfat
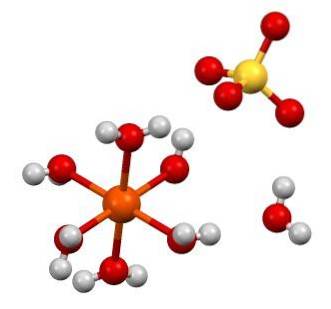
Die chemische Formel FeSO4 hebt hervor, dass dieses Salz aus Fe-Ionen bestehtzwei+ Und so4zwei- im Verhältnis 1: 1. Beide Ionen interagieren durch elektrostatische Kräfte derart, dass sie in einem orthorhombischen Kristallsystem angeordnet sind; was logischerweise dem wasserfreien Salz entspricht.
Im oberen Bild ist dagegen die Struktur von FeSO dargestellt47HzweiO. Die orangefarbene Kugel repräsentiert das Fe-Kationzwei+, die, wie zu sehen ist, mit sechs Wassermolekülen koordiniert, um ein Oktaeder zu bilden. Die Last des Glaubenszwei+ zieht das SO-Anion an4zwei-, und dies wiederum bildet, wenn beobachtet, eine Wasserstoffbindung mit dem siebten Wassermolekül.
Das siebte Wassermolekül (das vom Oktaeder entfernte) bildet ebenfalls eine weitere Wasserstoffbrücke mit einem anderen Wassermolekül, das zu einem benachbarten Oktaeder gehört. Das Ergebnis dieser Wechselwirkungen ist, dass sich der Kristall von orthorhombisch zu monoklin ändert..
B. die FeSO-Kristalle4 wasserfreies Hydrat, die Anionen SO4zwei- um den Glaubenzwei+ werden durch H-Moleküle ersetztzweiO. Diese Substitutionen stören die Elektronen d Eisen, das sie zwingt, verschiedene Energieniveaus zu durchlaufen; die für die Farbwechsel zwischen Weiß und Blaugrün verantwortlich sind.
Säure
Einige SO-Anionen4zwei- Sie können als Produkt des sauren Mediums protoniert werden. Infolgedessen innerhalb der FeSO-Kristalle47HzweiOder es können Moleküle von H vorhanden seinzweiSW4 wenn der pH-Wert sehr sauer ist; und daher kann das Berühren dieser schönen Kristalle unter solchen Bedingungen schwere Verbrennungen verursachen..
Physikalische und chemische Eigenschaften
Namen
Eisensulfat oder Eisen (II) sulfat
Molekularformel
-Wasserfreies Eisensulfat (FeSO4)
-Eisensulfat-Heptahydrat (FeSO4.7HzweiODER)
Molekulargewicht
Sie variiert mit dem Hydratationsgrad des Sulfats. Beispielsweise hat Eisensulfatheptahydrat ein Molekulargewicht von 278,02 g / mol; während das wasserfreie ein Molekulargewicht von 151,91 g / mol hat.
Aussehen
Es variiert auch mit dem Hydratationsgrad. Zum Beispiel hat die wasserfreie Form weiße orthorhombische Kristalle; Während in der Siebenwasserform die Kristalle monoklin blaugrünlich sind.
Geruch
Toilette
Dichte
Wasserfreies Eisensulfat ist die dichteste Salzform (3,65 g / cm)3). Die Heptahydratform ist dagegen am wenigsten dicht (1,895 g / cm)3).
Schmelzpunkt
Ebenso variiert dies je nach Hydratationsgrad. Die wasserfreie Form hat einen Schmelzpunkt von 680ºC (1.856ºF, 973 K) und die Heptahydratform von 60-64ºC (140-147ºF, 333-337 K)..
Wasserlöslichkeit
-Monohydratform: 44,69 g / 100 ml Wasser (77 ºC)
-Heptahydrat bildet 51,35 g / 100 ml Wasser (54 ºC).
Löslichkeit in Alkohol
Unlöslich.
Dampfdruck
1,95 kPa (Heptahydratform)
Brechungsindex
1.591 (Monohydrat) und 1.471 (Heptahydrat).
Stabilität
In Luft kann es schnell oxidieren und wird mit einer gelbbraunen Farbe bedeckt, was auf das Vorhandensein des Fe-Kations hinweist.3+. Die Oxidationsrate wird durch Zugabe von Alkali oder durch Belichtung erhöht..
Zersetzung
Beim Erhitzen zur Zersetzung entstehen giftige Dämpfe von Schwefeldioxid und Schwefeltrioxid, wobei ein rötliches Eisenoxid als Rückstand zurückbleibt..
Reaktionen
Es ist ein Reduktionsmittel, das auf Salpetersäure einwirkt und diese zu Stickstoffmonoxid reduziert. Ebenso reduziert es Chlor zu Chlorid und die toxischen Formen von Chrom, die in Zement zu Chrom (III) vorhanden sind, von geringerer Toxizität.
Synthese
Aus Stahlwolle
Eisensulfat wird durch Umsetzen von Stahl (Fe) mit Schwefelsäure hergestellt. Bei dem beschriebenen Verfahren wird das folgende Verfahren angewendet: Der Stahl wird in Form von Stahlwolle verwendet, die zuvor mit Aceton entfettet wurde..
Die Stahlwolle wird dann in ein Becherglas gegeben und vollständig mit 30-40% iger Schwefelsäure bedeckt, so dass der Säureaufschluss mehrere Stunden lang stattfinden kann; bis die Stahlwolle verschwindet. Es kann mehr Stahlwolle hinzugefügt und der Vorgang mehrmals wiederholt werden.
Grüne Kristalle, die sich möglicherweise gebildet haben, werden unter Verwendung von mit Schwefelsäure auf pH 1-2 angesäuertem Wasser wieder gelöst. Diese Lösung wird auf Filterpapier filtriert und der pH-Wert durch Zugabe von Natriumcarbonat eingestellt. Die Lösung wird gelagert, um den Kontakt mit Sauerstoff zu vermeiden und so die Oxidation von Fe zu verhindernzwei+ zum Glauben3+
Anschließend wird das Filtrat bei einer Temperatur zwischen 80 und 90 ° C eingedampft. Das Verfahren wird in Pietri-Kapseln durchgeführt, die auf einer Heizplatte platziert sind. Dann werden die gebildeten grünen Kristalle gesammelt, die zu einem Exsikkator gebracht werden können, um ihre Dehydratisierung zu vervollständigen..
Aus Pyrit
Eisensulfat wird auch durch Oxidation von Pyrit (FeS) hergestelltzwei).
2 FeSzwei + 7 O.zwei + 2 hzweiO => 2 FeSO4 + 2 hzweiSW4
Risiken
Inhalation von FeSO4 Verursacht Reizungen an Nase, Rachen und Lunge. Wenn Sie physischen Kontakt mit diesem Salz haben, kann dies zu Haut- und Augenreizungen führen. Darüber hinaus kann ein längerer Kontakt mit letzterem einen bräunlichen Fleck und Augenschäden verursachen..
Wiederholte Einnahme kann Übelkeit, Erbrechen, Magenschmerzen, Verstopfung und unregelmäßigen Stuhlgang verursachen..
Anzeichen einer Eisensulfatvergiftung sind: schwarzer oder blutiger Stuhl; bläuliche Haut und Nägel; Veränderungen des ausgeschiedenen Urinvolumens; Ohnmacht; trockener Mund oder trockene Augen; Brustschmerzen; Essen; Atemstörung.
Darüber hinaus können schnelle und unregelmäßige Herzschläge, erhöhter Durst und Hunger, ungewöhnliche Blässe und Atemnot auftreten..
Eine veränderte Gerinnung ist ein Hinweis auf eine Eisen (II) -sulfatvergiftung, wobei eine Verlängerung der Thrombin-, Prothrombin- und partiellen Thromboplastinzeiten beobachtet wird..
Die durchgeführten Studien zur Wirkung von Eisensulfat auf isolierte Muskeln des Herzens von Kaninchen zeigten, dass es zu einer Verringerung der von den untersuchten Herzmuskeln entwickelten maximalen Spannung sowie der maximalen Geschwindigkeit der Spannungsentwicklung führte.
Anwendungen
In der Landwirtschaft
-Es wird als Pestizid verwendet, um die Prise Weizen und den Verfall von Obstbäumen zu kontrollieren.
-Es wird zur Behandlung von Chlorose eingesetzt, einer Krankheit, die durch die gelbliche Farbe der Blätter gekennzeichnet ist, die durch die Alkalität der Böden verursacht wird..
-Eisensulfat kontrolliert die Alkalität und senkt den pH-Wert der Böden.
- Entfernt Moos und pflegt den Rasen.
Als Reagenz und in der Industrie
Im Rahmen der Verwendung von FeSO4 Als Reagenz und in der Industrie gibt es folgende:
-Analytisches Reagenz
-Rohstoff zur Gewinnung von Ferrit und magnetischem Eisenoxid
-Bestandteil für die Herstellung des anorganischen blauen Pigments
-Reduktionsmittel für Salpetersäure, Chlor und Chrom
-Bei der Herstellung anderer Sulfate
-Es wird in den Bädern der Galvanik mit Eisen verwendet
-Holzschutzmittel
-In Aluminiumradierungen
-Qualitative Analyse von Nitraten (braun-gelber Test durch Oxidation von Fezwei+)
-Polymerisationskatalysator
-Es wird als Vorstufe für die Synthese anderer Eisen verwendet
-Es wird industriell als Fleckenfixierer eingesetzt
-Bei der Herstellung von Eisenfarbstoff
-Beizmittel bei Wollfärbung
-Um Ahornholz eine silberne Farbe zu geben
-Eisenkatalysator in der Fenton-Reaktion
In der Medizin und zur Anreicherung von Lebensmitteln
Es wird zur Behandlung von Eisenmangelanämie unter Verwendung einer Dosis von 150-300 mg Eisensulfat dreimal täglich verwendet, was zu einer spürbaren Erhöhung der Hämoglobinkonzentration in einer Behandlungswoche führt..
Es wurde auch zur Anwendung bei schwangeren Frauen als Ergänzung zu ihrer Ernährung empfohlen. Eisensulfat wurde als Adstringens bei der Wundheilung bei Rindern verwendet..
Andere
Es wird zur Behandlung von Abwasser durch Flockung und auch zur Beseitigung von Phosphat aus diesen Gewässern verwendet. Eisensulfat-Heptahydrat wird zur Identifizierung der Pilzarten verwendet.
Verweise
- CR Scientific. (s.f.). Laborpräparation von Eisensulfat. Wiederhergestellt von: crscientific.com
- Werner H. Baur. (1964). Zur Kristallchemie von Salzhydraten. III. Die Bestimmung der Kristallstruktur von FeSO4.7HzweiOder (Melanterit). Acta Cryst. doi.org/10.1107/S0365110X64003000
- PubChem. (2019). Eisensulfat-Heptahydrat. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Marks Lynn. (19. Dezember 2014). Was ist Eisensulfat (Feosol)? Jede Gesundheit. Wiederhergestellt von: dailyhealth.com
- Wikipedia. (2019). Eisen (II) sulfat. Wiederhergestellt von: en.wikipedia.org



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.