
Reduktion (Chemie), woraus es besteht und Beispiele

Das die Ermäßigung Es ist all diese chemische Reaktion, bei der die Atome eines der Reaktanten Elektronen gewinnen; Was auch so zu sehen ist: Ihre Vakanz oder Ihr elektronisches "Unbehagen" wird reduziert. Ein Atom gewinnt Elektronen, wenn eine Spezies sie spendet; das heißt, es rostet.
Diese Art der Reaktion kann nicht von alleine ablaufen: Wenn eine Spezies die Elektronen akzeptiert, muss eine andere sie notwendigerweise aufgeben. Andernfalls würde Materie aus dem Nichts erzeugt und die Atome reduziert, nachdem Elektronen aus dem Vakuum gewonnen wurden. Daher handelt es sich um eine Redoxhalbreaktion (Reduktion / Oxidation).
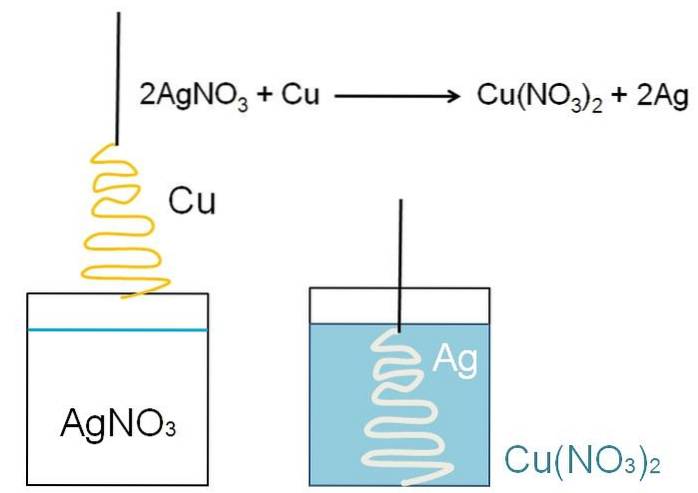
Ein anschauliches Beispiel für die Reduktion, die in Klassenzimmern gezeigt werden kann, ist die Reaktion zwischen einer metallischen Oberfläche von Kupfer und einer wässrigen Lösung von Silbernitrat, AgNO3.
In Lösung wird Silber als Kation Ag gefunden+, positiv geladen. Diese entreißen durch Wechselwirkung mit der Oberfläche des Kupfers, der wie ein Weihnachtsbaum geformt ist, die Elektronen aus den Kupferatomen. In diesem Fall ersetzt Kupfer Silber im Nitratsalz. und als Ergebnis Kupfernitrat, Cu (NO3)zwei.
Cu-Kationenzwei+ neben NEIN3- drehen Sie die Lösung bläulich; und Silber, weiß den Weihnachtsbaum, als ob er ihn mit Schnee bedeckte.
Artikelverzeichnis
- 1 Was ist die Reduzierung?
- 1.1 Anzahl der Sauerstoff
- 1.2 Elektronegatives Atom
- 2 Beispiele
- 2.1 Reduktion der organischen Chemie
- 2.2 Metallextraktion
- 3 Referenzen
Was ist die Reduzierung?
Bei der Reduktion wurde bereits gesagt, dass eine Spezies Elektronen gewinnt. Wie kann dies in einer chemischen Gleichung verifiziert werden? Zum Beispiel in der Gleichung für die Reaktion zwischen Cu und AgNO3, Woher wissen, wann die Reduzierung erfolgt? Um dies zu überprüfen, muss die Anzahl oder der Oxidationszustand bestimmt werden.
Die Elemente in ihren natürlichen Zuständen haben per Definition eine Oxidationsstufe gleich Null, da angenommen wird, dass sie weder Elektronen verloren noch gewonnen haben. Somit haben feste Metalle eine Oxidationsstufe von Null. Somit geht das Silber von +1 (Ag+) bis 0 (Ag). Die Ladung eines Metallions entspricht seiner Oxidationsstufe.
Andererseits kamen die Elektronen aus Kupfer: von 0 (Cu) auf +2 (Cu)zwei+). Nitratanion, NR3- bleibt unverändert, während beide Metalle Elektronen austauschen; Daher kann die Gleichung wie folgt geschrieben werden:
2Ag+ + Cu => 2Ag + Cuzwei+
Beachten Sie, dass sowohl Ladungen als auch Atome ausgeglichen sind..
Daraus besteht die chemische Reduktion: im Gewinn von Elektronen, die die Oxidationsstufen der Atome weniger positiv machen als die der Elektronen..
Sauerstoffzahl
Sauerstoff ist ein sehr elektronegatives und oxidierendes Atom. Wenn ein Atom mit ihm Verbindungen bildet (wie Oxide), haben sie positive Oxidationsstufen. Je größer die Anzahl der mit dem Atom wechselwirkenden Sauerstoffatome ist, desto positiver ist seine Oxidationsstufe. oder was ist das gleiche, es ist rostiger.
Wenn eine Verbindung weniger Sauerstoffatome aufweist, wird sie daher als weniger oxidiert bezeichnet. Das Atom verliert weniger Elektronen.
Ein klassisches Beispiel ist Kohlenmonoxid und Kohlendioxid. Für CO hat Kohlenstoff eine Oxidationsstufe von +2; während für den COzwei, seine Oxidationsstufe beträgt +4.
Also, wenn in einer Reaktion das COzwei es wandelt sich in CO um, es soll eine Reduktion auftreten; seitdem interagiert Kohlenstoff jetzt mit einem Sauerstoff und nicht mit zwei. Für die entgegengesetzte Reaktion wandelt sich CO in CO umzwei, Es ist die Rede von einer Oxidation von Kohlenstoff.
Dies gilt für alle Atome, insbesondere für Metalle in ihren Metalloxiden; Zum Beispiel CrOzwei (Cr4+) und CrO3 (Cr6+).
In chemischen Gleichungen, in denen eine Spezies Sauerstoff verliert, während die andere Spezies ihn gewinnt, soll ein Sauerstofftransfer stattfinden.
Elektronegatives Atom
Sie können jederzeit feststellen, ob eine Verringerung aufgetreten ist, indem Sie die Oxidationsstufe auf einen weniger positiven Wert ändern. Wie gerade erklärt, besteht eine schnelle Möglichkeit, dies zu bemerken, ohne überhaupt zu rechnen, darin, zu beobachten, ob die Sauerstoffatome in einer Verbindung abnehmen..
Dasselbe kann mit jedem anderen Atom geschehen, das elektronegativer ist als das Atom, das Elektronen gewinnt oder verliert.
Zum Beispiel, wenn die CF.4 reagiert so, dass es zu CH wird4, es soll dann eine Reduktion stattgefunden haben; da Fluor viel elektronegativer ist als das Wasserstoffatom. Infolgedessen wird der Kohlenstoff im CH weniger oxidiert4 das in der CF4, das ist gleichbedeutend damit, dass es reduziert wurde.
Beispiele
Reduktion der organischen Chemie
Das CF-Beispiel4 und CH4 es spiegelt wider, was bei organischen Reaktionen passiert, bei denen die Reduktion der Teilladung eines Atoms als elektronischer Gewinn betrachtet wird. Dies gilt insbesondere für die Reduktion sauerstoffhaltiger funktioneller Gruppen..
Betrachten Sie beispielsweise die Gruppen ROH, RCHO und COOH. Der erste entspricht Alkoholen, bei denen Kohlenstoff an Sauerstoff (C-OH) bindet; Die zweite ist die Aldehydgruppe, in der Kohlenstoff eine Doppelbindung mit Sauerstoff bildet und auch an Wasserstoff gebunden ist (C = O-H). und die dritte ist die Carboxylgruppe.
In der Carboxylgruppe bildet Kohlenstoff mit einem O eine Doppelbindung und mit einem anderen O eine Einfachbindung (HO-C = O)..
Daher tritt eine Reduktion auf, wenn eine Carbonsäure in einen Alkohol umgewandelt wird:
RCOOH => ROH
Metallextraktion
Die chemische Reduktion ist äußerst wichtig bei der Gewinnung von Metallen aus ihren Mineralien. Einige der Reaktionen sind:
HgS + O.zwei => Hg + SOzwei
Quecksilbersulfid wird zu metallischem Quecksilber reduziert.
CuzweiS + O.zwei => 2Cu + SOzwei
Kupfersulfid wird zu metallischem Kupfer reduziert.
2ZnS + 30zwei => 2ZnO + 2SOzwei
ZnO + C => Zn + CO (beachten Sie die Übertragung von O)
Zinksulfid wird zuerst zu seinem Monoxid und dann zu seiner metallischen Form reduziert.
VertrauenzweiODER3 + 3CO => 2Fe + 3COzwei
Eisenoxid wird zu metallischem Eisen reduziert.
WO3 + 3Hzwei => W + 3HzweiODER
Und Wolframtrioxid wird zu metallischem Wolfram reduziert.
Als Übung kann die Oxidationszahl des Metalls bestimmt werden, bevor es reduziert wird.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Chemie LibreTexts. (9. Dezember 2018). Oxidations-Reduktions-Reaktionen. Wiederhergestellt von: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (04. Juli 2018). Die Definition der Reduktion in der Chemie. Wiederhergestellt von :oughtco.com
- Hultzman R. (2019). Reduktion in der Chemie: Definition & Überblick. Studie. Wiederhergestellt von: study.com
- Clark J. (2013). Definitionen von Oxidation und Reduktion (Redox). Wiederhergestellt von: chemguide.co.uk
- Tutoransicht. (s.f.). Reduktionsreaktion. Wiederhergestellt von: chemie.tutorvista.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.