
Was ist eine koordinative kovalente Bindung? (mit Beispielen)

EIN kovalente Bindung koordinieren oder Koordinationsverbindung isteine Art von Bindung, bei der eines der gebundenen Atome alle gemeinsamen Elektronen liefert.
In einer einfachen kovalenten Bindung liefert jedes Atom ein Elektron an die Bindung. Andererseits werden in einer Koordinationsbindung die Atome, die das Elektron zur Bildung einer Bindung abgeben, als Donoratom bezeichnet, während das Atom, das das Elektronenpaar zum Verbinden akzeptiert, als Akzeptoratom bezeichnet wird (Clark, 2012)..
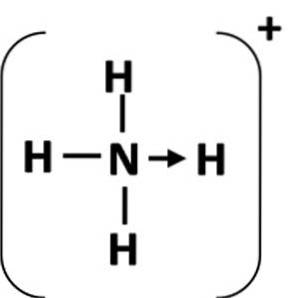
Eine Koordinationsbindung wird durch einen Pfeil dargestellt, der von den Donoratomen ausgeht und am Akzeptoratom endet (Abbildung 1). In einigen Fällen kann der Donor ein Molekül sein.
In diesem Fall kann ein Atom im Molekül das Elektronenpaar abgeben, das die Lewis-Base wäre, während das Molekül mit der Akzeptorkapazität die Lewis-Säure wäre (Coordinate Covalent Bond, S.F.)..
Eine Koordinationsbindung hat ähnliche Eigenschaften wie eine einfache kovalente Bindung. Verbindungen mit dieser Art von Bindung haben im Allgemeinen einen niedrigen Schmelz- und Siedepunkt mit einer nicht vorhandenen Coulomb-Wechselwirkung zwischen den Atomen (im Gegensatz zur Ionenbindung) und den Verbindungen, die in Wasser sehr gut löslich sind (Atkins, 2017)..
Einige Beispiele für koordinierte kovalente Bindungen
Das häufigste Beispiel für eine Koordinationsbindung ist das Ammoniumion, das durch die Kombination eines Ammoniakmoleküls und eines Protons aus einer Säure gebildet wird.
In Ammoniak hat das Stickstoffatom nach Beendigung seines Oktetts ein einzelnes Elektronenpaar. Geben Sie dieses einzelne Paar an das Wasserstoffion ab, damit das Stickstoffatom zum Donor wird. Das Wasserstoffatom wird zum Akzeptor (Schiller, S.F.).
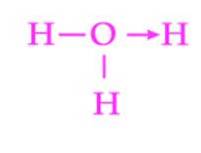
Ein weiteres häufiges Beispiel für eine Dativbindung ist die Bildung des Hydroniumions. Wie beim Ammoniumion dient das freie Elektronenpaar des Wassermoleküls als Donor für das Proton, das der Akzeptor ist (Abbildung 2)..
Es ist jedoch zu beachten, dass nach Herstellung der Koordinationsbindung alle an Sauerstoff gebundenen Wasserstoffatome genau gleichwertig sind. Wenn ein Wasserstoffion wieder zerfällt, gibt es keine Unterscheidung, welcher der Wasserstoffatome freigesetzt wird.
Ein hervorragendes Beispiel für eine Lewis-Säure-Base-Reaktion, die die Bildung einer koordinierten kovalenten Bindung veranschaulicht, ist die Bildungsreaktion des Bortrifluoridaddukts mit Ammoniak..
Bortrifluorid ist eine Verbindung, die keine Edelgasstruktur um das Boratom herum aufweist. Bor hat nur 3 Elektronenpaare in seiner Valenzschale, so dass BF3 als elektronenarm gilt.
Das ungeteilte Elektronenpaar Ammoniakstickstoff kann verwendet werden, um diesen Mangel zu überwinden, und es wird eine Verbindung gebildet, die eine Koordinationsbindung beinhaltet..
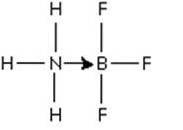
Dieses Elektronenpaar aus Stickstoff wird an das leere p-Orbital von Bor abgegeben. Hier ist Ammoniak die Lewis-Base und BF3 die Lewis-Säure.
Koordinationschemie
Es gibt einen Zweig der anorganischen Chemie, der sich ausschließlich der Untersuchung von Verbindungen widmet, die Übergangsmetalle bilden. Diese Metalle verbinden andere Atome oder Moleküle durch Koordinationsbindungen zu komplexen Molekülen..
Diese Moleküle sind als Koordinationsverbindungen bekannt, und die Wissenschaft, die sie untersucht, wird als Koordinationschemie bezeichnet..
In diesem Fall ist die an das Metall gebundene Substanz, die der Elektronendonor sein würde, als Ligand bekannt, und Koordinationsverbindungen sind allgemein als Komplexe bekannt..
Zu den Koordinationsverbindungen gehören Substanzen wie Vitamin B12, Hämoglobin und Chlorophyll, Farbstoffe und Pigmente sowie Katalysatoren zur Herstellung organischer Substanzen (Jack Halpern, 2014)..
Ein Beispiel für ein Komplexion wäre der Kobaltkomplex [Co (NHzweiCHzweiCHzweiNHzwei) 2ClNH3]]zwei+ Was wäre das Dichloraminethylendiamin-Kobalt (IV)?.
Die Chemie der Koordination entstand aus der Arbeit von Alfred Werner, einem Schweizer Chemiker, der verschiedene Verbindungen von Kobalt (III) -chlorid und Ammoniak untersuchte. Nach Zugabe von Salzsäure stellte Werner fest, dass das Ammoniak nicht vollständig entfernt werden konnte. Er schlug dann vor, Ammoniak enger an das zentrale Kobaltion zu binden.
Bei Zugabe von wässrigem Silbernitrat war jedoch eines der gebildeten Produkte festes Silberchlorid. Die Menge an gebildetem Silberchlorid hing mit der Anzahl der an Cobalt (III) -chlorid gebundenen Ammoniakmoleküle zusammen..
Zum Beispiel, wenn Silbernitrat zu CoCl gegeben wurde3 6NH3, Die drei Chloride wurden zu Silberchlorid.
Wenn jedoch Silbernitrat zu CoCl gegeben wurde3 5NH3, nur 2 der 3 Chloride bildeten Silberchlorid. Wenn CoCl behandelt wurde3.4NH3 mit Silbernitrat fiel eines der drei Chloride als Silberchlorid aus.
Die resultierenden Beobachtungen deuteten auf die Bildung von Komplex- oder Koordinationsverbindungen hin. In der internen Koordinationssphäre, die in einigen Texten auch als erste Sphäre bezeichnet wird, sind die Liganden direkt an das Zentralmetall gebunden.
In der äußeren Koordinationssphäre, die manchmal als zweite Sphäre bezeichnet wird, sind andere Ionen an das komplexe Ion gebunden. Werner erhielt 1913 den Nobelpreis für seine Koordinationstheorie (Einführung in die Koordinationschemie, 2017).
Diese Koordinationstheorie lässt Übergangsmetalle zwei Arten von Valenz haben: die erste Valenz, die durch die Oxidationszahl des Metalls bestimmt wird, und die andere Valenz, die als Koordinationszahl bezeichnet wird..
Die Oxidationszahl gibt an, wie viele kovalente Bindungen im Metall gebildet werden können (Beispiel: Eisen (II) erzeugt FeO), und die Koordinationszahl gibt an, wie viele Koordinationsbindungen im Komplex gebildet werden können (Beispiel: Eisen mit Koordinationszahl 4 erzeugt [FeCl4]]- und [FeCl4]]zwei-) (Koordinationsverbindungen, 2017).
Im Fall von Kobalt hat es eine Koordinationsnummer 6. Deshalb wurde in Werners Experimenten bei Zugabe von Silbernitrat immer die Menge an Silberchlorid erhalten, die ein hexakoordiniertes Kobalt hinterlassen würde..
Die Koordinationsbindungen dieser Art von Verbindung haben die Eigenschaft, gefärbt zu sein.
Tatsächlich sind sie für die typische Färbung eines Metalls verantwortlich (rotes Eisen, blaues Kobalt usw.) und sind wichtig für Atomabsorptions- und Emissionsspektrophotometrietests (Skodje, S.F.).
Verweise
- Atkins, P. W. (2017, 23. Januar). Chemische Verbindung. Von britannica.com wiederhergestellt.
- Clark, J. (2012, September). CO-ORDINATE (DATIVE COVALENT) BONDING. Von chemguide.co.uk wiederhergestellt.
- Kovalente Bindung koordinieren. (S.F.). Von chemie.tutorvista wiederhergestellt.
- Koordinationsverbindungen. (2017, 20. April). Von chem.libretexts.org wiederhergestellt.
- Einführung in die Koordinationschemie. (2017, 20. April). Von chem.libretexts.org wiederhergestellt.
- Jack Halpern, G. B. (2014, 6. Januar). Koordinationsverbindung. Von britannica.com wiederhergestellt.
- Schiller, M. (S.F.). Koordinieren Sie die kovalente Bindung. Von easychem.com wiederhergestellt.
- Skodje, K. (S.F.). Koordinate Covalent Bond: Definition & Beispiele. Von study.com wiederhergestellt.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.