
Dreifacher Punkt
Was ist der dreifache Punkt?
Das dreifacher Punkt ist ein Begriff auf dem Gebiet der Thermodynamik, der sich auf die Temperatur und den Druck bezieht, bei denen drei Phasen einer Substanz gleichzeitig in einem Zustand des thermodynamischen Gleichgewichts existieren. Dieser Punkt besteht für alle Substanzen, obwohl die Bedingungen, unter denen sie erreicht werden, zwischen den einzelnen Substanzen sehr unterschiedlich sind..
Ein Tripelpunkt kann auch mehr als eine Phase des gleichen Typs für eine bestimmte Substanz umfassen. Das heißt, es werden zwei verschiedene feste, flüssige oder gasförmige Phasen beobachtet. Helium, insbesondere sein Isotop Helium-4, ist ein gutes Beispiel für einen Tripelpunkt, an dem zwei einzelne flüssige Phasen beteiligt sind: normale Flüssigkeit und Superfluid..
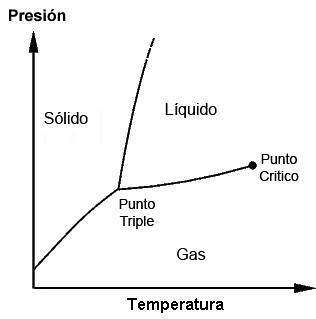
Wofür und wann wird der Tripelpunkt verwendet??
Der Tripelpunkt von Wasser wird verwendet, um das Kelvin zu definieren, die Basiseinheit der thermodynamischen Temperatur im internationalen Einheitensystem (SI). Dieser Wert wird per Definition festgelegt und nicht gemessen..
Die Tripelpunkte jeder Substanz können unter Verwendung von Phasendiagrammen beobachtet werden, die grafische Darstellungen sind, die es ermöglichen, die Grenzbedingungen der festen, flüssigen, gasförmigen Phasen (und in besonderen Fällen anderer) einer Substanz während ihrer Ausübung zu demonstrieren Änderungen der Temperatur, des Drucks und / oder der Löslichkeit.
Eine Substanz befindet sich an ihrem Schmelzpunkt, an dem Feststoff auf Flüssigkeit trifft. Es kann auch an seinem Siedepunkt gefunden werden, an dem Flüssigkeit auf Gas trifft. Am dreifachen Punkt werden jedoch die drei Phasen erreicht. Diese Diagramme sind für jede Substanz unterschiedlich, wie später zu sehen sein wird.
Der Dreipunkt kann effektiv bei der Thermometerkalibrierung verwendet werden, wobei Dreipunktzellen verwendet werden.
Hierbei handelt es sich um Proben von Substanzen unter isolierten Bedingungen (innerhalb von Glaszellen), die sich in ihrem Tripelpunkt mit bekannten Temperatur- und Druckbedingungen befinden und somit die Untersuchung der Genauigkeit der Thermometermessungen erleichtern..
Die Untersuchung dieses Konzepts wurde auch bei der Erforschung des Planeten Mars verwendet, bei dem versucht wurde, den Meeresspiegel während der in den 1970er Jahren durchgeführten Missionen zu ermitteln..
Dreifacher Punkt Wasser

Die genauen Druck- und Temperaturbedingungen, bei denen Wasser in seinen drei Gleichgewichtsphasen - flüssiges Wasser, Eis und Dampf - koexistiert, treten bei einer Temperatur von genau 273,16 K (0,01 ºC) und einem Dampfpartialdruck von 611,656 Pascal (0,00603659 atm) auf..
Zu diesem Zeitpunkt ist die Umwandlung der Substanz in eine der drei Phasen mit minimalen Änderungen ihrer Temperatur oder ihres Drucks möglich. Obwohl der Gesamtdruck des Systems über dem für den Tripelpunkt erforderlichen Wert liegen könnte, erreicht das System den Tripelpunkt auf die gleiche Weise, wenn der Partialdruck des Dampfes bei 611.656 Pa liegt..
In der vorherigen Abbildung ist es möglich, die Darstellung des Tripelpunkts (oder dreifacher Punkt, in englischer Sprache) eines Stoffes, dessen Diagramm dem von Wasser ähnlich ist, je nach Temperatur und Druck, die erforderlich sind, um diesen Wert zu erreichen.
Bei Wasser entspricht dieser Punkt dem Mindestdruck, bei dem flüssiges Wasser vorhanden sein kann. Bei Drücken unter diesem Tripelpunkt (z. B. im Vakuum) und bei Verwendung einer Erwärmung mit konstantem Druck wandelt sich festes Eis direkt in Wasserdampf um, ohne durch Flüssigkeit zu gelangen. Dies ist ein Prozess, der Sublimation genannt wird.
Jenseits dieses Mindestdrucks (P.tp) schmilzt das Eis zuerst unter Bildung von flüssigem Wasser und verdampft oder kocht erst dann unter Bildung von Dampf.
Bei vielen Substanzen ist der Temperaturwert an seinem Tripelpunkt die Mindesttemperatur, bei der die flüssige Phase existieren kann, bei Wasser jedoch nicht. Bei Wasser ist dies nicht der Fall, da der Schmelzpunkt von Eis in Abhängigkeit vom Druck abnimmt, wie durch die grün gepunktete Linie in der vorherigen Abbildung dargestellt..
In Hochdruckphasen hat das Wasser ein ziemlich komplexes Phasendiagramm, in dem fünfzehn bekannte Eisphasen (bei unterschiedlichen Temperaturen und Drücken) sowie zehn verschiedene Tripelpunkte dargestellt sind, die in der folgenden Abbildung dargestellt sind:
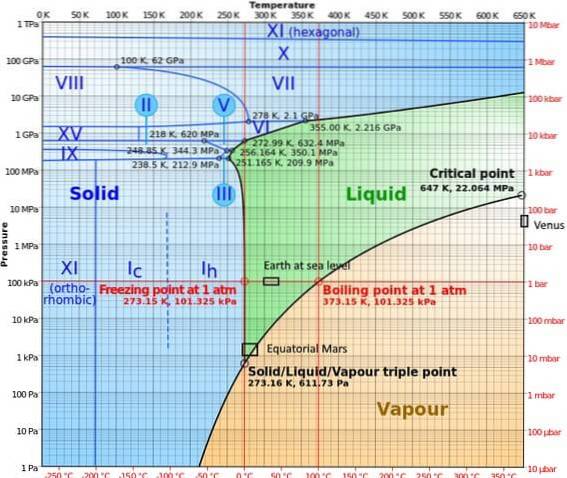
Es kann festgestellt werden, dass unter Hochdruckbedingungen Eis im Gleichgewicht mit der Flüssigkeit existieren kann; Das Diagramm zeigt, dass die Schmelzpunkte mit dem Druck ansteigen. Bei konstant niedrigen Temperaturen und steigendem Druck kann sich der Dampf direkt in Eis umwandeln, ohne die flüssige Phase zu durchlaufen..
In diesem Diagramm sind auch die verschiedenen Bedingungen dargestellt, die auf den Planeten auftreten, auf denen der Tripelpunkt untersucht wurde (Erde auf Meereshöhe und in der Äquatorzone des Mars)..
Das Diagramm macht deutlich, dass der Tripelpunkt je nach Standort aus Gründen des atmosphärischen Drucks und der Temperatur variiert und nicht nur aufgrund der Intervention des Experimentators..
Cyclohexan-Tripelpunkt
Cyclohexan ist ein Cycloalkan mit der Summenformel C.6H.12. Diese Substanz hat die Besonderheit, Dreipunktbedingungen zu haben, die wie im Fall von Wasser leicht reproduziert werden können, da dieser Punkt bei einer Temperatur von 279,47 K und einem Druck von 5,388 kPa liegt.
Unter diesen Bedingungen wurde beobachtet, dass die Verbindung mit minimalen Änderungen von Temperatur und Druck kocht, sich verfestigt und schmilzt..
Benzol-Tripelpunkt
In einem ähnlichen Fall wie Cyclohexan Benzol (eine organische Verbindung mit der chemischen Formel C.6H.6) hat Dreipunktbedingungen, die in einem Labor leicht reproduzierbar sind.
Seine Werte liegen bei 278,5 K und 4,83 kPa, daher ist auch das Experimentieren mit dieser Komponente auf Anfängerebene üblich..
Verweise
- Wikipedia. (s.f.). Wikipedia. Abgerufen von en.wikipedia.org
- Britannica, E. (1998). Enzyklopädie Britannica. Von britannica.com abgerufen
- Power, N. (s.f.). Atomkraft. Von nuklear-power.net abgerufen
- Wagner, W., Saul, A. & Prub, A. (1992). Internationale Gleichungen für den Druck entlang des Schmelzens und entlang der Sublimationskurve von normalem Wasser. Bochum.
- S. G. Penoncello, R. T. Jacobsen & A. R. Goodwin (1995). Eine thermodynamische Eigenschaftsformulierung für Cyclohexan.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.