
Kolligative Eigenschaften (mit Formeln)
Das kolligatives Eigentum ist eine Eigenschaft einer Substanz, die von der Anzahl der darin vorhandenen Partikel abhängt oder variiert (in Form von Molekülen oder Atomen), ohne von der Art dieser Partikel abzuhängen.
Mit anderen Worten können diese auch als Eigenschaften von Lösungen erklärt werden, die von der Beziehung zwischen der Anzahl der gelösten Partikel und der Anzahl der Lösungsmittelpartikel abhängen. Dieses Konzept wurde 1891 vom deutschen Chemiker Wilhelm Ostwald eingeführt, der die Eigenschaften von gelösten Stoffen in drei Kategorien einteilte.

Diese Kategorien proklamierten, dass die kolligativen Eigenschaften ausschließlich von der Konzentration und Temperatur des gelösten Stoffes und nicht von der Art seiner Partikel abhingen..
Darüber hinaus hingen additive Eigenschaften wie Masse von der Zusammensetzung des gelösten Stoffes ab, und konstitutionelle Eigenschaften hingen stärker von der Molekülstruktur des gelösten Stoffes ab..
Artikelverzeichnis
- 1 Kolligative Eigenschaften
- 1.1 Abnahme des Dampfdrucks
- 1.2 Erhöhung der Siedetemperatur
- 1.3 Gefriertemperatur senken
- 1.4 Osmotischer Druck
- 2 Referenzen
Kolligative Eigenschaften
Die kolligativen Eigenschaften werden hauptsächlich für verdünnte Lösungen (aufgrund ihres nahezu idealen Verhaltens) untersucht und sind wie folgt:
Dampfdruckabfall
Man kann sagen, dass der Dampfdruck einer Flüssigkeit der Gleichgewichtsdruck der Dampfmoleküle ist, mit denen diese Flüssigkeit in Kontakt steht.
Ebenso wird die Beziehung dieser Drücke mit dem Raoultschen Gesetz erklärt, das ausdrückt, dass der Partialdruck einer Komponente gleich dem Produkt des Molenbruchs der Komponente durch den Dampfdruck der Komponente in ihrem reinen Zustand ist:
P.ZU = X.ZU . PºZU
In diesem Ausdruck:
P.ZU = Partialer Dampfdruck der Komponente A im Gemisch.
X.ZU = Molenbruch der Komponente A..
PºZU= Dampfdruck der reinen Komponente A..
Im Fall der Abnahme des Dampfdrucks eines Lösungsmittels tritt dies auf, wenn ein nichtflüchtiger gelöster Stoff hinzugefügt wird, um eine Lösung zu bilden. Bekanntlich und per Definition neigt eine nichtflüchtige Substanz nicht zur Verdunstung.
Aus diesem Grund ist der Dampfdruck umso niedriger, je mehr dieses gelösten Stoffs dem flüchtigen Lösungsmittel zugesetzt wird, und desto weniger Lösungsmittel kann austreten und in einen gasförmigen Zustand übergehen..
Wenn das Lösungsmittel auf natürliche oder gewaltsame Weise verdampft, verbleibt schließlich eine Menge Lösungsmittel, ohne zusammen mit dem nichtflüchtigen gelösten Stoff zu verdampfen..
Dieses Phänomen lässt sich mit dem Konzept der Entropie besser erklären: Wenn die Moleküle von der flüssigen Phase in die Gasphase übergehen, nimmt die Entropie des Systems zu..
Dies bedeutet, dass die Entropie dieser Gasphase immer größer ist als die des flüssigen Zustands, da die Gasmoleküle ein größeres Volumen einnehmen..
Wenn dann die Entropie des flüssigen Zustands durch Verdünnung zunimmt, obwohl sie an einen gelösten Stoff gebunden ist, nimmt der Unterschied zwischen den beiden Systemen ab. Aus diesem Grund verringert die Abnahme der Entropie auch den Dampfdruck..
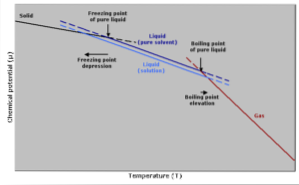
Siedetemperaturanstieg
Der Siedepunkt ist die Temperatur, bei der ein Gleichgewicht zwischen der flüssigen und der gasförmigen Phase besteht. Zu diesem Zeitpunkt entspricht die Anzahl der flüssig werdenden (kondensierenden) Gasmoleküle der Anzahl der zu Gas verdampfenden flüssigen Moleküle..
Die Zugabe eines gelösten Stoffes bewirkt, dass sich die Konzentration flüssiger Moleküle verdünnt, wodurch die Verdunstungsrate abnimmt. Dies erzeugt eine Änderung des Siedepunkts, um die Änderung der Lösungsmittelkonzentration auszugleichen..
Mit anderen einfacheren Worten ist die Siedetemperatur einer Lösung höher als die des Lösungsmittels in seinem reinen Zustand. Dies wird durch einen mathematischen Ausdruck ausgedrückt, der unten gezeigt wird:
ΔTb = i. K.b . m
In diesem Ausdruck:
ΔTb = T.b (Lösung) - T.b (Lösungsmittel) = Variation der Siedetemperatur.
i = van't Hoff-Faktor.
K.b = Siedekonstante des Lösungsmittels (0,512 ºC / Mol für Wasser).
m = Molalität (mol / kg).
Reduzierung der Gefriertemperatur
Die Gefriertemperatur eines reinen Lösungsmittels nimmt ab, wenn eine Menge gelösten Stoffes zugesetzt wird, da sie durch dasselbe Phänomen beeinflusst wird, dass der Dampfdruck abnimmt..
Dies geschieht, weil durch Verringern des Dampfdrucks des Lösungsmittels durch Verdünnen eines gelösten Stoffes eine niedrigere Temperatur erforderlich ist, um ihn gefrieren zu lassen..
Die Art des Gefrierprozesses kann ebenfalls berücksichtigt werden, um dieses Phänomen zu erklären: Damit eine Flüssigkeit gefrieren kann, muss sie einen geordneten Zustand erreichen, in dem sie Kristalle bildet..
Wenn die Flüssigkeit Verunreinigungen in Form von gelösten Stoffen enthält, ist die Flüssigkeit weniger geordnet. Aus diesem Grund hat die Lösung größere Schwierigkeiten beim Einfrieren als ein Lösungsmittel ohne Verunreinigungen..
Diese Reduzierung wird ausgedrückt als:
ΔTF. = -i. K.F. . m
Im obigen Ausdruck:
ΔTF. = T.F. (Lösung) - T.F. (Lösungsmittel) = Gefriertemperaturschwankung.
i = van't Hoff-Faktor.
K.F. = Gefrierkonstante des Lösungsmittels (1,86 ºC kg / mol für Wasser).
m = Molalität (mol / kg).
Osmotischer Druck
Der als Osmose bekannte Prozess ist die Tendenz eines Lösungsmittels, durch eine semipermeable Membran von einer Lösung zur anderen (oder von einem reinen Lösungsmittel zur Lösung) zu gelangen..
Diese Membran stellt eine Barriere dar, durch die einige Substanzen gelangen können und andere nicht, wie im Fall von semipermeablen Membranen in den Zellwänden von tierischen und pflanzlichen Zellen..
Der osmotische Druck ist dann definiert als der Mindestdruck, der auf eine Lösung ausgeübt werden muss, um den Durchgang ihres reinen Lösungsmittels durch eine semipermeable Membran zu stoppen..
Es ist auch als Maß für die Tendenz einer Lösung bekannt, das reine Lösungsmittel aufgrund der Wirkung der Osmose zu erhalten. Diese Eigenschaft ist kolligativ, da sie von der Konzentration des gelösten Stoffs in der Lösung abhängt, die als mathematischer Ausdruck ausgedrückt wird:
Π. V = n. R. T oder auch π = M. R. T.
In diesen Ausdrücken:
n = Anzahl der Mol Partikel in der Lösung.
R = universelle Gaskonstante (8,314472 J. K.-1 . Maulwurf-1).
T = Temperatur in Kelvin.
M = Molarität.
Verweise
- Wikipedia. (s.f.). Kolligative Eigenschaften. Abgerufen von en.wikipedia.org
- BC. (s.f.). Kolligative Eigenschaften. Von opentextbc.ca wiederhergestellt
- Bosma, W. B. (s.f.). Kolligative Eigenschaften. Abgerufen von Chemistryexplained.com
- Sparknotes. (s.f.). Kolligative Eigenschaften. Von sparknotes.com wiederhergestellt
- Universität, F. S. (s.f.). Kolligative Eigenschaften. Abgerufen von chem.fsu.edu



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.