
Struktur, Eigenschaften, Verwendungen, Risiken von Natriumnitrit (NaNO2)

Das Natriumnitrit ist ein kristalliner anorganischer Feststoff, der durch ein Natriumion Na gebildet wird+ und ein Nitrition NOzwei-. Seine chemische Formel lautet NaNOzwei. Es ist ein weißer kristalliner Feststoff, der dazu neigt, Wasser aus der Umgebung zu absorbieren, das heißt, er ist hygroskopisch.
In Gegenwart von Luft oxidiert es langsam zu Natriumnitrat NaNO3. Es hat oxidierende Eigenschaften (es oxidiert andere Verbindungen) und auch reduzierende Eigenschaften (es wird durch andere Verbindungen oxidiert).

Es ist auf natürliche Weise im menschlichen Körper vorhanden und wird als Konservierungsmittel für Wurstwaren und geräucherten Fisch verwendet, da es das Wachstum schädlicher Mikroorganismen verhindert.
Es hat eine wichtige Verwendung bei der Notfallbehandlung von Cyanidvergiftungen, da es die toxische und tödliche Wirkung dieser Verbindung verringert. Es muss jedoch mit großer Vorsicht angewendet werden und funktioniert nicht in allen Fällen.
Es wurde festgestellt, dass es Augeninfektionen verhindern kann, die durch Kontamination von Kontaktlinsen durch Mikroorganismen verursacht werden. Einige Studien weisen darauf hin, dass der Verzehr mit Lebensmitteln Krebs verursachen kann, aber es wird geschätzt, dass dies durch die Einnahme von Vitamin C mit solchen Lebensmitteln vermieden werden kann.
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Siedepunkt
- 3.5 Dichte
- 3.6 Löslichkeit
- 3,7 pH
- 3.8 Andere Eigenschaften
- 4 Erhalten
- 4.1 Präsenz im Körper
- 5 Verwendungen
- 5.1 In der Lebensmittelindustrie
- 5.2 Als Notfallbehandlung bei Cyanidvergiftung
- 5.3 Zur Erweiterung von Blutgefäßen
- 5.4 Gegen einige Parasiten
- 5.5 Um Organschäden zu vermeiden
- 5.6 Um Infektionen durch Kontaktlinsen zu vermeiden
- 5.7 In verschiedenen Anwendungen
- 6 Risiken oder Unannehmlichkeiten
- 7 Referenzen
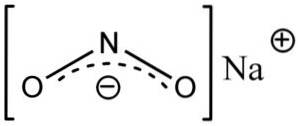
Struktur
Natriumnitrit besteht aus dem Natriumkation Na+ und das Nitritanion NOzwei-.
Im Nitritanion NOzwei- Stickstoff hat eine Wertigkeit von +3 und Sauerstoff von -2. Aus diesem Grund hat das Anion eine einzige globale negative Ladung.
Nitritanion NRzwei- hat eine Winkelstruktur, dh die Bindungen von Stickstoff (N) mit Sauerstoffatomen (O) bilden einen Winkel.
Nomenklatur
- Natriumnitrit
- Natriumnitrit
- Salpetersäure Natriumsalz.
Eigenschaften
Körperlicher Status
Gelblich-weißer kristalliner Feststoff. Orthorhombische Kristalle.
Molekulargewicht
68,995 g / mol
Schmelzpunkt
271 ºC
Siedepunkt
Es kocht nicht. Es zersetzt sich über 320 ºC
Dichte
2,17 g / cm3 bei 20 ºC
Löslichkeit
Wasserlöslich: 84,8 g / 100 g Wasser bei 25 ºC. In Ethanol schwer löslich. In Methanol mäßig löslich. In Diethylether schwer löslich.
pH
Seine wässrigen Lösungen sind alkalisch mit einem pH-Wert von ungefähr 9. Dies liegt daran, dass salpetrige Säure eine schwache Säure ist, die dazu neigt, nicht zu dissoziieren, also das NO-Ionzwei- versuche ein Proton H zu nehmen+ von Wasser, um HNO zu bildenzwei, was zur Bildung von OH-Ionen führt- die Alkalität erzeugen.
NICHTzwei- + H.zweiO → HNOzwei + Oh-
Andere Eigenschaften
Natriumnitrit NaNOzwei in Gegenwart von Luft oxidiert langsam zu Natriumnitrat NaNO3. Es ist ein hygroskopischer Feststoff, da er Wasser aus der Umwelt aufnimmt.
Es hat oxidierende Eigenschaften (es kann andere Verbindungen oxidieren) und auch reduzierende Eigenschaften (es kann durch andere Verbindungen oxidiert werden).
Wenn es mit Materialien wie Holz, Papier oder Textilien in Kontakt kommt, kann es dazu führen, dass sie sich gefährlich entzünden..
Mit Säuren findet seine Zersetzung statt, wobei ein Gemisch aus braunen toxischen Gasen von Stickoxiden (NOx).
Erhalten
Es kann durch Erhitzen von Natriumnitrat NaNO erhalten werden3 mit Blei Pb:
Älterer Bruder3 + Pb → NaNOzwei + PbO
Präsenz im Körper
Nitritanionen sind natürlicherweise in Blut und Geweben vorhanden, da sie durch NO-Oxidation gebildet werden..
Anwendungen
In der Lebensmittelindustrie
Es wird zum Marinieren von Fleisch verwendet, da es als Farb- und Geschmacksretentionsmittel und als Konservierungsmittel wirkt, da es das Wachstum von Mikroorganismen kontrolliert und insbesondere die Entwicklung von Fleisch vermeidet Clostridium botulinum Botulismus Krankheit verursachen.
Natriumnitrit in Fleisch reagiert mit Hämoglobin in roten Blutkörperchen oder roten Blutkörperchen in diesem Lebensmittel. Wird auch in geräuchertem Räucherfisch verwendet.

Als Notfallbehandlung bei Cyanidvergiftung
Natriumnitrit wird zur Behandlung einer akuten Cyanidvergiftung eingesetzt. Es ist ein Gegenmittel gegen dieses ernste Problem.
Seine Wirkung beruht auf der Tatsache, dass es die Bildung von Methämoglobin (einer Art von Hämoglobin) im Blut begünstigt, das Cyanidionen einfängt und diese nicht freisetzt und somit verhindert, dass sie in Zellen freigesetzt werden, wodurch sie weniger toxisch werden.
Im Falle einer Cyanidvergiftung wird Natriumnitrit intravenös angewendet, wobei etwa 12 Minuten benötigt werden, um Methämoglobin zu erzeugen. Trotz dieser Verzögerung bietet es aufgrund seiner vasodilatatorischen Wirkung auch Schutz..
Zur Erweiterung von Blutgefäßen
Es wird zur Behandlung der pulmonalen arteriellen Hypertonie angewendet, da es die Blutgefäße erweitert und so den Blutdruck senkt. Es wird geschätzt, dass dieser Effekt auf die Tatsache zurückzuführen ist, dass er in Stickoxid NO umgewandelt wird, das durch Entspannung der weichen Muskeln wirkt.
Die Ursachen für seine Wirksamkeit werden jedoch noch untersucht..
Gegen einige Parasiten
Bestimmte Forscher fanden heraus, dass Natriumnitrit das Wachstum und die Vermehrung des Darmparasiten hemmt Blastocystis hominis auch wenn es gegen andere Medikamente resistent ist.
NaNO wurde gefundenzwei erzeugt den Tod dieses Parasiten durch Apoptose, was eine Art Selbstmord der Parasitenzelle ist. Natriumnitrit bewirkt, dass Darmzellen NO produzieren, was in diesem Prozess wichtig zu sein scheint.
Um Organschäden zu vermeiden
Nach einigen Studien ist Nitrit ein starker Inhibitor der Schädigung von Herz und Leber bei ischämischen Prozessen (verminderte Durchblutung in einem Teil des Körpers). Es wird angenommen, dass dies auf die Tatsache zurückzuführen ist, dass es sich um eine biologische Reserve von NO handelt.
Es wurde der Schluss gezogen, dass es verwendet werden kann, um Organschäden nach Wiederherstellung des Blutflusses zu verhindern, der durch einen Herzinfarkt, eine Bauchoperation mit hohem Risiko oder eine Organtransplantation unterbrochen wurde..
Um Infektionen durch das Tragen von Kontaktlinsen zu vermeiden
NaNO wurde gefundenzwei verhindert die Bildung von Filmen pathogener Mikroorganismen Staphylococcus aureus Y. Pseudomonas aeruginosa über Kontaktlinsen.

In verschiedenen Anwendungen
Natriumnitrit wird zur Herstellung von Farbstoffen, Arzneimitteln und verschiedenen organischen Verbindungen verwendet.
Dient auch als Korrosionsinhibitor in Allzweckfetten.
Risiken oder Unannehmlichkeiten
Eines der Probleme bei der Verwendung von Natriumnitrit bei Cyanidvergiftungen besteht darin, dass es bei Kindern schwerwiegende Herz-Kreislauf-Störungen verursacht..
Nicht empfohlen für Brandopfer, bei denen gleichzeitig Cyanid und Kohlenmonoxid (CO) ausgesetzt sind. CO verringert die Fähigkeit des Blutes, Sauerstoff zu transportieren, also die Verabreichung von NaNOzwei würde den sauerstoffarmen Zustand im Blut des Patienten verschlimmern.
Inhaliertes Natriumnitrit ist reizend und giftig, es kann das Herz-Kreislauf-System und das Zentralnervensystem schädigen. Darüber hinaus ist es umweltschädlich.
Mit der Nahrung aufgenommenes Natriumnitrit kann schädlich sein. Nitrit reagiert beim Erreichen des Magens mit bestimmten Verbindungen unter Bildung von Nitrosaminen, die Krebs verursachen können.
Diese Reaktionen können in Gegenwart von Vitamin C vermieden werden.
Bestimmten konsultierten Quellen zufolge ist das Risiko des Verzehrs von Nitriten mit Wurstwaren oder Fisch minimal, da Nitrit natürlich im Speichel vorhanden ist.
Die Quellen weisen darauf hin, dass dieses Risiko im Vergleich zu den großen Vorteilen des Verzehrs von Lebensmitteln, die frei von schädlichen Mikroorganismen sind, ebenfalls minimal ist.
Verweise
- Bhattacharya, R. und Flora, S.J.S. (2015). Cyanidtoxizität und ihre Behandlung. Im Handbuch der Toxikologie chemischer Kampfstoffe (2. Auflage). Von sciencedirect.com wiederhergestellt.
- UNS. Nationalbibliothek für Medizin. (2019). Natriumnitrit. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov.
- Kim, D.J. et al. (2017). Die Antibiofilm-Wirksamkeit von Stickoxid auf weichen Kontaktlinsen. BMC Ophthalmol 17, 206 (2017). Von bmcophthalmol.biomedcentral.com wiederhergestellt.
- Ramis-Ramos, G. (2003). Antioxidantien. Synthetische Antioxidantien. In der Encyclopedia of Food Sciences and Nutrition (2. Auflage). Von sciencedirect erholt.
- Barozzi Seabra, A. und Durán, N. (2017). Stickoxidspender zur Behandlung vernachlässigter Krankheiten. In Stickoxidspendern. Von sciencedirect.com wiederhergestellt.
- Duranski, M.R. et al. (2005). Zytoprotektive Wirkungen von Nitrit während der In-vivo-Ischämie-Reperfusion von Herz und Leber. J Clin Invest 2005; 115 (5): 1232 & ndash; 1240. Von ncbi.nlm.nih.gov wiederhergestellt.
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.