
Aluminiumnitratformeln, Eigenschaften, Verwendungen und Risiken
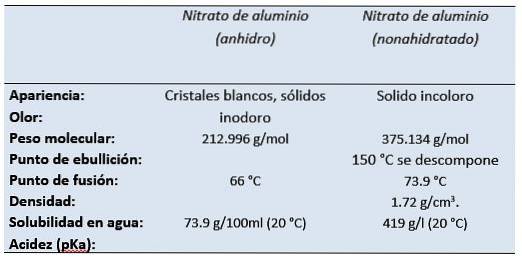
Das Aluminiumnitrat Es ist das Aluminiumsalz der Salpetersäure. Aluminiumnitrat-Nonahydrat erscheint bei Raumtemperatur als farbloser Feststoff mit dem Geruch von Salpetersäure..
Sie sind nicht brennbar, können aber die Verbrennung brennbarer Materialien beschleunigen. Wenn große Mengen Aluminiumnitrat beteiligt sind oder wenn brennbares Material fein verteilt ist, kann eine Explosion auftreten..

Längerer Kontakt mit Feuer oder Hitze kann zu einer Explosion führen. Wenn sie mit Feuer in Kontakt kommen, produzieren sie Stickoxide. Zu seinen Verwendungszwecken gehören das Raffinieren von Erdöl sowie das Färben und Gerben von Leder..
Es ist ein weißes, wasserlösliches Salz, das am häufigsten in seiner kristallinen Nonahydratform (Aluminiumnitrat-Nonahydrat) vorkommt..
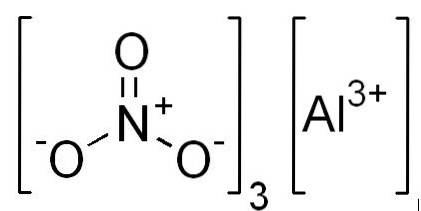
Artikelverzeichnis
- 1 Formeln
- 2 Struktur
- 2.1 In 2D
- 2.2 In 3D
- 3 Physikalische und chemische Eigenschaften
- 3.1 Reaktivitätswarnungen
- 3.2 Reaktionen mit Luft und Wasser
- 3.3 Entflammbarkeit
- 3.4 Reaktivität
- 3.5 Toxizität
- 4 Verwendungen
- 5 Klinische Wirkungen
- 6 Sicherheit und Risiken
- 6.1 GHS-Gefahrenklassen
- 6.2 Sicherheitshinweiscodes
- 7 Referenzen
Formeln
- Aluminiumnitrat: Al (NR3)3
- Aluminiumnitrat-Nonahydrat: Al (NR3)3 9 STUNDENzweiODER
- CAS: 13473-90-0 Aluminiumnitrat (wasserfrei)
- CAS: 14797-65-0 Aluminiumnitrat (Nonahydrat)
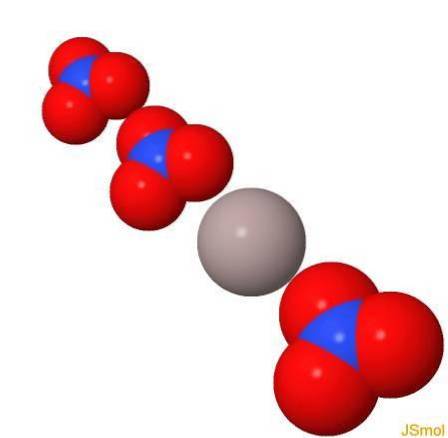
Struktur
In 2D
In 3d
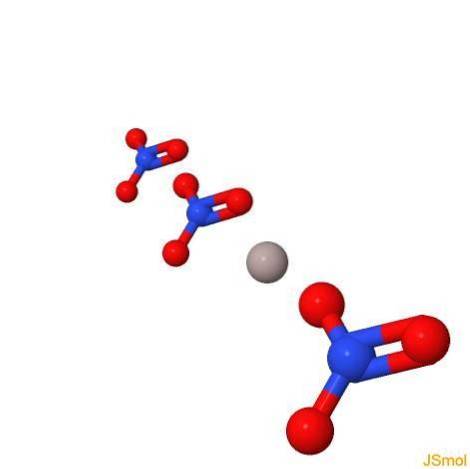
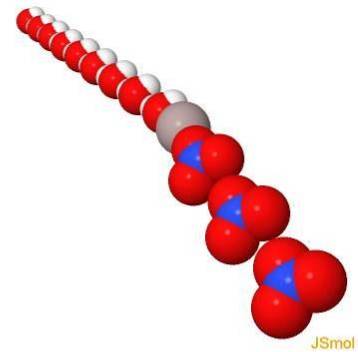
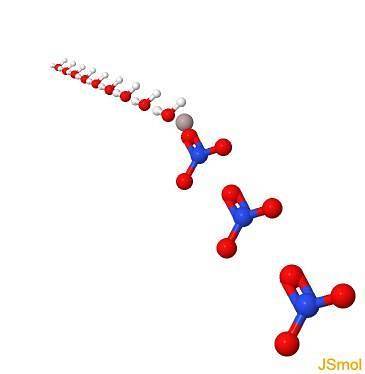
Physikalische und chemische Eigenschaften
- Aluminiumnitrat gehört zur reaktiven Gruppe der anorganischen Nitrat- und Nitritverbindungen.
- Das Nitration ist ein mehratomiges Ion mit der Summenformel NO3 - und ist die konjugierte Base der Salpetersäure.
- Fast alle anorganischen Nitratsalze sind bei Standardtemperatur und -druck wasserlöslich..
- Nitratverbindungen haben aufgrund ihrer Aktivität als Oxidationsmittel, der Anwesenheit von frei verfügbarem Stickstoff oder ihrer hohen Löslichkeit ein breites Anwendungsspektrum..
Reaktivitätswarnungen
Aluminiumnitrat ist ein starkes Oxidationsmittel.
Reaktionen mit Luft und Wasser
Aluminiumnitrat zerfließt (es hat die Eigenschaft, Feuchtigkeit aus der Luft zu absorbieren, um eine wässrige Lösung zu bilden). Es ist wasserlöslich. Seine wässrigen Lösungen sind sauer.
Entzündbarkeit
Nitrate und Nitrite sind explosive Verbindungen. Einige dieser Substanzen können sich beim Erhitzen oder bei einem Brand explosionsartig zersetzen. Sie können durch Hitze oder Verunreinigungen explodieren. Behälter können beim Erhitzen explodieren.
Besondere Gefahren durch Verbrennungsprodukte: Bei einem Brand mit Aluminiumnitrat können sich giftige Stickoxide bilden.
Reaktivität
Nitrate und Nitrite können als extrem starke Oxidationsmittel wirken, und Gemische mit Reduktionsmitteln oder reduzierten Materialien wie organischen Substanzen können explosiv sein. Reagiere mit Säuren unter Bildung von giftigem Stickstoffdioxid.
Im Allgemeinen reagieren Nitrat- und Nitritsalze mit redoxaktiven Kationen (Übergangsmetalle und Metalle der Gruppen 3a, 4a und 5a des Periodensystems sowie das Ammoniumkation [NH4] +) reaktiver mit organischen Materialien und Wirkstoffen unter Umgebungsbedingungen.
Aluminiumnitrat ist ein Oxidationsmittel. Gemische mit Alkylestern können explodieren. Gemische mit Phosphor, Zinn (II) chlorid oder anderen Reduktionsmitteln können explosionsartig reagieren.
Toxizität
Menschen sind einer Nitrat- und Nitrit-Toxizität ausgesetzt, wobei Kinder besonders anfällig für Methämoglobinämie sind.
Die Einnahme großer Dosen Aluminiumnitrat führt zu Magenreizungen, Übelkeit, Erbrechen und Durchfall. Kontakt mit Staub reizt Augen und Haut.
Anwendungen
Nitrate und Nitrite werden in der Landwirtschaft häufig (und in sehr großen Mengen) als Düngemittel verwendet, da sie bereit sind, Stickstoff für das Pflanzenwachstum abzubauen und freizusetzen, und weil sie löslich sind, wodurch Nitrationen von den Wurzeln der Pflanze absorbiert werden können.
Nitratverbindungen werden auch häufig als industrieller Rohstoff verwendet, wenn ein Oxidationsmittel oder eine Nitrationenquelle erforderlich ist..
Aluminiumnitrat wird zur Herstellung von Labor-, Kosmetik- und Körperpflegechemikalien verwendet. In der Industrie wird es als Zwischenprodukt bei der Herstellung anderer Substanzen verwendet.
Es wird beim Gerben von Leder, in Antitranspirantien, Korrosionsinhibitoren, bei der Uranextraktion, bei der Erdölraffination und als Nitrierungsmittel verwendet..
Aluminiumnitrat-Nonahydrat und andere hydratisierte Aluminiumnitrate haben viele Anwendungen. Diese Salze werden zur Herstellung von Aluminiumoxid zur Herstellung von Isolierpapieren, in Heizelementen von Kathodenstrahlröhren und in den Kernlaminaten von Transformatoren verwendet. Hydratisierte Salze werden auch zur Extraktion aktinidischer Elemente verwendet.
Klinische Wirkungen
Aluminium ist allgegenwärtig, es ist das am häufigsten vorkommende Metall in der Erdkruste. Der größte Teil der menschlichen Exposition kommt von Lebensmitteln. Es ist in einigen pharmazeutischen Produkten enthalten. In der Industrie ist es weit verbreitet.
Aluminium hemmt den Knochenumbau und verursacht Osteomalazie. Es wird angenommen, dass es die Erythropoese hemmt und Anämie verursacht.
Akute Vergiftungen sind selten. Lösliche Formen von Aluminium haben aufgrund ihrer größeren Absorption ein größeres Toxizitätspotential als unlösliche Formen..
Patienten mit Nierenversagen sind anfällig für Aluminiumtoxizität, entweder durch Aluminium im Dialysat oder andere exogene Quellen, insbesondere Phosphatbindemittel und aluminiumhaltige Antazida..
Chronische Exposition gegenüber Aluminiumstaub kann zu Atemnot, Husten, Lungenfibrose, Pneumothorax, Pneumokoniose, Enzephalopathie, Schwäche, Koordinationsstörungen und epileptiformen Anfällen führen..
Aluminiumsalze können Augen- und Schleimhautreizungen, Bindehautentzündungen, Dermatosen und Ekzeme verursachen..
Obwohl Aluminium und seine Verbindungen beim Menschen kaum Hinweise auf Karzinogenität zeigten, wurde die Exposition gegenüber anderen Substanzen, die an der Aluminiumproduktion beteiligt sind, mit Karzinogenität in Verbindung gebracht..
Sicherheit und Risiken
Gefahrenhinweise des global harmonisierten Systems zur Einstufung und Kennzeichnung von Chemikalien (GHS).
Das global harmonisierte System zur Einstufung und Kennzeichnung von Chemikalien (GHS) ist ein international vereinbartes System, das von den Vereinten Nationen geschaffen wurde und die verschiedenen in verschiedenen Ländern verwendeten Klassifizierungs- und Kennzeichnungsstandards durch weltweit einheitliche Kriterien ersetzen soll..
Die Gefahrenklassen (und das entsprechende Kapitel des GHS), die Klassifizierungs- und Kennzeichnungsstandards sowie die Empfehlungen für Aluminiumnitrat und Aluminiumnitrat-Nonahydrat lauten wie folgt (Europäische Chemikalienagentur, 2017; Vereinte Nationen, 2015; PubChem, 2017):
GHS-Gefahrenklassen
H272: Kann das Feuer verstärken; Oxidationsmittel [Warnung Oxidierende Flüssigkeiten; Oxidierende Feststoffe - Kategorie 3] (PubChem, 2017).
H301: Giftig beim Verschlucken [Akute Toxizitätsgefahr, oral - Kategorie 3] (PubChem, 2017).
H315: Verursacht Hautreizungen [Warnung Hautkorrosion / -reizung - Kategorie 2] (PubChem, 2017).
H318: Verursacht schwere Augenschäden [Gefahr Schwerer Augenschaden / Augenreizung - Kategorie 1] (PubChem, 2017).
H319: Verursacht schwere Augenreizungen [Warnung Schwere Augenschäden / Augenreizungen - Kategorie 2A] (PubChem, 2017).
Codes für Vorsichtsmaßnahmen
P210, P220, P221, P264, P270, P280, P301 + P310, P302 + P352, P305 + P351 + P338, P310, P321, P330, P332 + P313, P337 + P313, P362, P370 + P378, P405 und P501 (PubChem, 2017).





Verweise
- ChemIDplus (2017) 3D-Struktur von 13473-90-0 - Aluminiumnitrat [Bild] Wiederhergestellt aus: chem.nlm.nih.gov.
- ChemIDplus (2017) 3D-Struktur von 7784-27-2 - Aluminiumnitrat-Nonahydrat [Bild] Wiederhergestellt aus: chem.nlm.nih.gov.
- Daisa, J. (2017) Shell Oil Refinery in der Abenddämmerung [Bild] Wiederhergestellt von: flickr.com.
- Edgar181 (2008) Aluminiumnitrat [Bild]. Wiederhergestellt von: wikipedia.org.
- Europäische Chemikalienagentur (ECHA). (2016). Aluminiumnitrat. Kurzprofil. Abgerufen am 8. Februar 2017 von echa.europa.eu.
- Gefahrstoffdatenbank (HSDB). TOXNET. (2017). Aluminiumnitrat. Bethesda, MD, EU: Nationalbibliothek für Medizin. Wiederhergestellt von: chem.nlm.nih.gov.
- JSmol (2017) Nitrat [Bild] Wiederhergestellt von: chemapps.stolaf.edu.
- Wikipedia. (2017). Aluminiumnitrat. Abgerufen am 8. Februar 2017 von: wikipedia.org.
- Wikipedia. (2017). Aluminiumnitrat-Nonahydrat. Abgerufen am 8. Februar 2017 von: wikipedia.org.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.