
Rutherfords Atommodellgeschichte, Experimente, Postulate

Das Rutherford-Atommodell ist die Beschreibung des Atoms, das der britische Physiker Ernest Rutherford (1871-1937) geschaffen hat, als er 1911 dank der berühmten Streuexperimente, die seinen Namen tragen, den Atomkern entdeckte.
Die Idee des Atoms („unteilbarAuf Griechisch) als kleinste Komponente der Materie war es eine intellektuelle Schöpfung, die im antiken Griechenland um 300 v. Chr. Geboren wurde. Wie so viele andere griechische Konzepte wird das Konzept des Atoms auf der Grundlage von Logik und Argumentation entwickelt, nicht jedoch auf der Grundlage von Experimenten..
Die bekanntesten atomistischen Philosophen waren Demokrit von Abdera (460 - 360 v. Chr.), Epikur von Samos (341 - 270 v. Chr.) Und Titus Lucretius (98 - 54 v. Chr.). Die Griechen stellten sich vier verschiedene Arten von Atomen vor, die den vier Elementen entsprachen, aus denen sich die Materie zusammensetzte: Luft, Wasser, Erde und Feuer.
Später fügte Aristoteles ein fünftes Element hinzu: den Äther, der die Sterne bildete, da die anderen vier Elemente rein terrestrisch waren.
Die Eroberungen von Alexander dem Großen, dessen Lehrer Aristoteles war, erweiterten seinen Glauben in der gesamten Antike, von Spanien bis Indien, und damit jahrhundertelang die Idee von Atom schuf einen eigenen Platz in der Welt der Wissenschaft.
Artikelverzeichnis
- 1 Das Atom ist nicht mehr unteilbar
- 1.1 Crookes-Rohr
- 2 Die Entdeckung des Elektrons
- 3 Rutherford-Streuexperimente: der Atomkern und das Proton
- 3.1 Beobachtungen
- 4 Postulate von Rutherfords Atommodell
- 5 Einschränkungen
- 6 Artikel von Interesse
- 7 Referenzen
Das Atom ist nicht mehr unteilbar
Die Vorstellungen der griechischen Philosophen über die Struktur der Materie hielten Hunderte von Jahren an, bis ein englischer Chemiker und Schullehrer namens John Dalton (1776-1844) 1808 die Ergebnisse seiner Experimente veröffentlichte..
Dalton stimmte zu, dass Elemente aus extrem kleinen Teilchen bestehen, die Atome genannt werden. Er ging jedoch noch weiter und stellte fest, dass alle Atome desselben Elements gleich sind, dieselbe Größe, dieselbe Masse und dieselben chemischen Eigenschaften haben, wodurch sie während einer chemischen Reaktion unverändert bleiben..
Dies ist das erste wissenschaftlich fundierte Atommodell. Wie die Griechen betrachtete Dalton das Atom weiterhin als unteilbar, weshalb es an Struktur mangelte. Daltons Genie veranlasste ihn jedoch, eines der großen Erhaltungsprinzipien der Physik zu beachten:
- Bei chemischen Reaktionen, Atome werden weder erzeugt noch zerstört, Sie ändern nur ihre Verteilung.
Und er stellte fest, wie chemische Verbindungen durch „zusammengesetzte Atome“ (Moleküle) gebildet wurden:
- Wenn sich zwei oder mehr Atome verschiedener Elemente zu derselben Verbindung verbinden, geschieht dies immer in Massenanteilen definitiv und konstant.
Das 19. Jahrhundert war das große Jahrhundert der Elektrizität und des Magnetismus. Einige Jahre nach Daltons Veröffentlichungen werfen die Ergebnisse einiger Experimente Zweifel an der Unteilbarkeit des Atoms auf..
Crookes Rohr
Die Crookes-Röhre war ein Gerät, das vom britischen Chemiker und Meteorologen William Crookes (1832-1919) entworfen wurde. Das Experiment, das Crookes 1875 durchführte, bestand darin, zwei Elektroden, von denen eine als Gas bezeichnet wurde, in ein mit Gas unter niedrigem Druck gefülltes Rohr zu legen Kathode und ein anderer rief an Anode.
Durch Feststellen einer Potentialdifferenz zwischen den beiden Elektroden leuchtete das Gas mit einer Farbe, die für das verwendete Gas charakteristisch war. Diese Tatsache deutete darauf hin, dass es innerhalb des Atoms eine bestimmte Organisation gab und diese daher nicht unteilbar war..
Darüber hinaus erzeugte diese Strahlung eine schwache Fluoreszenz an der Wand der Glasröhre vor der Kathode und schnitt den Schatten einer kreuzförmigen Markierung aus, die sich innerhalb der Röhre befand.
Es war eine mysteriöse Strahlung, die als "Kathodenstrahlen" bekannt war, die in einer geraden Linie zur Anode wanderte und hochenergetisch war, mechanische Effekte erzeugen konnte und die zu einer positiv geladenen Platte oder auch durch Magnete abgelenkt wurde..
Die Entdeckung des Elektrons
Die Strahlung in der Crookes-Röhre konnte keine Wellen sein, da sie eine negative Ladung trug. Joseph John Thomson (1856 - 1940) kam 1887 auf die Antwort, als er die Beziehung zwischen der Ladung und der Masse dieser Strahlung fand und feststellte, dass sie immer dieselbe war: 1,76 x 10elf C / kg, unabhängig von dem in der Röhre eingeschlossenen Gas oder dem zur Herstellung der Kathode verwendeten Material.
Thomson nannte diese Partikel Körperchen. Indem er seine Masse im Verhältnis zu seiner elektrischen Ladung maß, kam er zu dem Schluss, dass jeder Korpuskel weitaus kleiner als ein Atom war. Deshalb schlug er vor, dass sie Teil davon sein müssen, um so das zu entdecken Elektron.
Der britische Wissenschaftler war der erste, der ein grafisches Modell des Atoms skizzierte, indem er eine Kugel mit eingefügten Punkten zeichnete, die aufgrund ihrer Form den Spitznamen "Pflaumenpudding" erhielt. Diese Entdeckung warf jedoch andere Fragen auf:
- Wenn die Materie neutral ist und das Elektron eine negative Ladung hat: In welchem Teil des Atoms befindet sich die positive Ladung, die die Elektronen neutralisiert??
- Wenn die Masse des Elektrons geringer ist als die des Atoms, woraus besteht dann der Rest des Atoms??
- Warum wurden die so erhaltenen Teilchen immer Elektronen und nie irgendein anderer Typ??
Rutherford-Streuexperimente: der Atomkern und das Proton
Bis 1898 hatte Rutherford zwei Arten von Uranstrahlung identifiziert, die er nannte Alpha Y. Beta.
Natürliche Radioaktivität wurde bereits 1896 von Marie Curie entdeckt. Alpha-Teilchen sind positiv geladen und einfach Heliumkerne, aber zu diesem Zeitpunkt war das Konzept eines Kerns noch nicht bekannt. Rutherford wollte es herausfinden.
Eines der Experimente, die Rutherford 1911 an der Universität von Manchester mit Unterstützung von Hans Geiger durchführte, bestand darin, ein dünnes Goldblech mit Partikeln zu bombardieren Alpha, deren Ladung ist positiv. Um die Goldfolie platzierte er einen fluoreszierenden Bildschirm, mit dem sie die Auswirkungen des Bombardements visualisieren konnten..
Beobachtungen
Rutherford und seine Assistenten untersuchten die Auswirkungen auf den Fluoreszenzschirm und stellten fest, dass:
- Ein sehr hoher Prozentsatz der Alpha-Partikel passierte das Blatt ohne merkliche Abweichung.
- Einige weichen in ziemlich steilen Winkeln ab
- Und nur sehr wenige prallten den ganzen Weg zurück
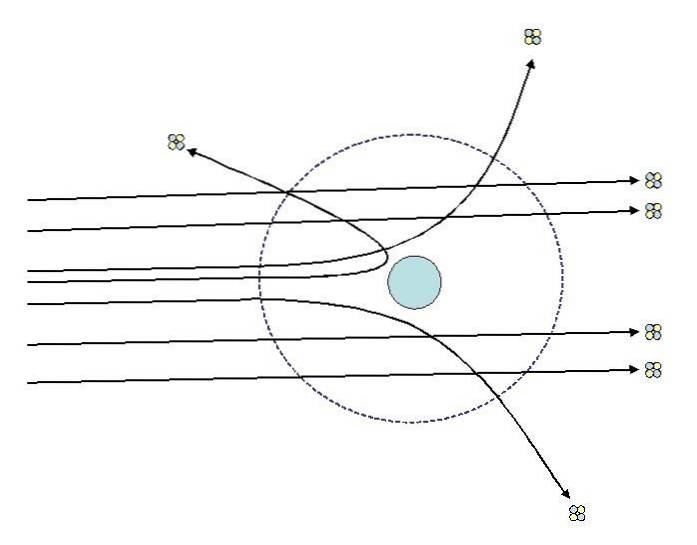
Die Beobachtungen 2 und 3 überraschten die Forscher und führten sie zu der Annahme, dass die für die Streuung der Strahlen verantwortliche Person eine positive Ladung haben muss und dass diese verantwortliche Person aufgrund der Beobachtung Nr. 1 viel kleiner war als die der Alpha-Partikel..
Rutherford selbst sagte darüber, dass es "... als ob Sie ein 15-Zoll-Marineprojektil auf ein Blatt Papier abgefeuert hätten und das Projektil zurückprallte und Sie schlug." Dies konnte definitiv nicht durch das Thompson-Modell erklärt werden.
Rutherford analysierte seine Ergebnisse unter dem klassischen Gesichtspunkt und entdeckte die Existenz des Atomkerns, in dem die positive Ladung des Atoms konzentriert war, was ihm seine Neutralität verlieh..
Rutherford setzte seine Streuexperimente fort. Bis 1918 waren Stickstoffgasatome das neue Ziel für Alpha-Partikel..
Auf diese Weise entdeckte er Wasserstoffkerne und wusste sofort, dass der einzige Ort, von dem diese Kerne kommen konnten, Stickstoff selbst war. Wie war es möglich, dass Wasserstoffkerne Teil von Stickstoff waren??
Rutherford schlug dann vor, dass der Wasserstoffkern, ein Element, dem bereits die Ordnungszahl 1 zugewiesen wurde, ein grundlegendes Teilchen sein muss. ich rufe Sie an Proton, Griechisches Wort zu bezeichnen Zuerst. Die Entdeckungen des Atomkerns und des Protons sind also auf diesen brillanten Neuseeländer zurückzuführen.
Rutherfords Atommodell postuliert
Das neue Modell war ganz anders als das Thompson. Dies waren seine Postulate:
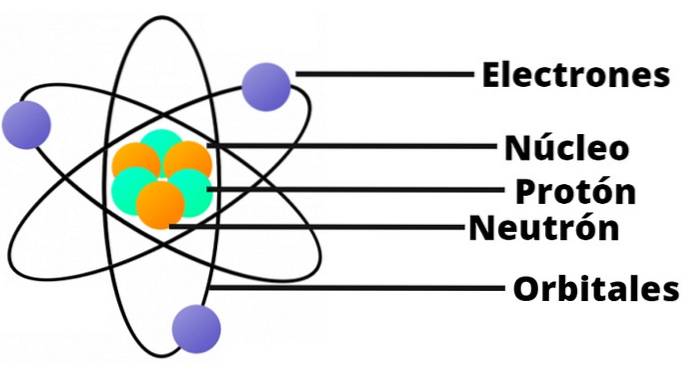
- Das Atom enthält einen positiv geladenen Kern, der trotz seiner geringen Größe fast die gesamte Masse des Atoms enthält.
- Elektronen umkreisen den Atomkern in großen Entfernungen und in kreisförmigen oder elliptischen Bahnen.
- Die Nettoladung des Atoms ist Null, da die Ladungen der Elektronen die im Kern vorhandene positive Ladung kompensieren..
Rutherfords Berechnungen zeigten auf einen Kern mit Kugelform und einem Radius von nur 10-fünfzehn m, wobei der Wert des Atomradius etwa 100.000-mal größer ist, da die Kerne vergleichsweise weit voneinander entfernt sind: in der Größenordnung von 10-10 m.

Dies erklärt, warum die meisten Alpha-Partikel reibungslos durch die Folie gingen oder nur eine geringe oder keine Durchbiegung aufwiesen..
Auf der Skala alltäglicher Objekte würde das Rutherford-Atom aus einem Kern von der Größe eines Baseballs bestehen, während der Atomradius etwa 8 km betragen würde. Daher kann das Atom fast alles als leerer Raum betrachtet werden..
Dank seiner Ähnlichkeit mit einem Miniatur-Sonnensystem wurde es als "Planetenmodell des Atoms" bekannt. Die elektrostatische Anziehungskraft zwischen Kern und Elektronen wäre analog zur Anziehungskraft zwischen Sonne und Planeten..
Einschränkungen
Es gab jedoch gewisse Meinungsverschiedenheiten in Bezug auf einige beobachtete Tatsachen:
- Wenn die Idee akzeptiert wird, dass das Elektron um den Kern kreist, sollte das Elektron kontinuierlich Strahlung emittieren, bis es mit dem Kern kollidiert, was zur Folge hat, dass das Atom in weniger als einer Sekunde zerstört wird. Dies ist glücklicherweise nicht das, was tatsächlich passiert.
- Darüber hinaus sendet das Atom in bestimmten Fällen bestimmte Frequenzen elektromagnetischer Strahlung aus, wenn es Übergänge zwischen einem Zustand höherer Energie und einem Zustand niedrigerer Energie gibt, und nur diesen Frequenzen, nicht anderen. Wie erklärt man die Tatsache, dass Energie quantisiert wird??
Trotz dieser Einschränkungen und der Tatsache, dass es heute viel ausgefeiltere Modelle gibt, die den beobachteten Tatsachen entsprechen, ist das Rutherford-Atommodell für den Studenten immer noch nützlich, um einen ersten erfolgreichen Ansatz für das Atom und seine Teilchenbestandteile zu erhalten..
In diesem Modell des Atoms erscheint das Neutron nicht, ein weiterer Bestandteil des Kerns, der erst 1932 entdeckt wurde.
Kurz nachdem Rutherford sein Planetenmodell vorgeschlagen hatte, modifizierte der dänische Physiker Niels Bohr es 1913, um zu erklären, warum das Atom nicht zerstört wird, und wir sind immer noch hier, um diese Geschichte zu erzählen..
Artikel von Interesse
Schrödingers Atommodell.
Atomic de Broglie Modell.
Chadwick-Atommodell.
Heisenberg-Atommodell.
Perrins Atommodell.
Thomsons Atommodell.
Dirac Jordan Atommodell.
Atommodell von Demokrit.
Bohr-Atommodell.
Dalton-Atommodell.
Verweise
- Rex, A. 2011. Grundlagen der Physik. Pearson. 618-621.
- Zapata, F. 2007. Unterrichtsnotizen für den Lehrstuhl für Strahlenbiologie und Strahlenschutz. School of Public Health der Zentraluniversität von Venezuela.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.