
Myosin Eigenschaften, Struktur, Typen und Funktion
Das Myosin Es ist ein molekularer Motor, Protein in der Natur, der in der Lage ist, Aktinfilamente im Cytosol zu bewegen. Die Energie, die die Verdrängung von Myosin antreibt, stammt aus der Hydrolyse von ATP. Aus diesem Grund wird Myosin häufig als mechanochemisches Enzym definiert.
In Eukaryoten ist Myosin ein sehr häufig vorkommendes Protein. Es gibt verschiedene Klassen von Myosin, die von einer Familie von Genen kodiert werden. Bei Hefen werden 5 Klassen unterschieden, während bei Säugetieren Dutzende beschrieben wurden.
Myosin hat eine Vielzahl von Funktionen. Myosin I ist zusammen mit Actin an der Bewegung von Keratozyten beteiligt.
Myosin II verleiht der Plasmamembran Steifheit, ist an der Zytokinese und Muskelkontraktion beteiligt. Beide Myosine I und II arbeiten bei der Zellmigration zusammen. Die Myosine I und V führen den Vesikeltransport entlang der Aktinfilamente durch.
Artikelverzeichnis
- 1 Struktur
- 2 Funktionen
- 3 Funktionen
- 3.1 Muskelkontraktion
- 3.2 Zytokinese
- 3.3 Versteifung der Kortikalis
- 3.4 Zelladhäsion
- 3.5 Verschiebung einiger Vesikel
- 4 Krankheiten im Zusammenhang mit Myosin
- 4.1 Myosine und Hörverlust
- 4.2 Myosin X und Krebs
- 5 Referenzen
Struktur
In elektronenmikroskopischen Aufnahmen weist die typische Struktur von Myosin-Isoformen drei Domänen auf: Kopf, Hals und Schwanz. Durch Hydrolyse mit Chymotrypsin wird ein Segment aus Kopf und Hals erhalten, das als schweres Meromyosin (HMM) bezeichnet wird, und ein Segment des Schwanzes, das als leichtes Meromyosin (LMM) bezeichnet wird..
Die Kopfdomäne ist das N-terminale Ende der schweren Kette und die Schwanzdomäne ist das C-terminale Ende der leichten Kette.
Die Klassen von Myosin können durch die Anzahl der Polypeptidketten, aus denen es besteht, und die Häufigkeit und Klasse der am Hals gebundenen leichten Kette unterschieden werden.
Myosin I hat eine Polypeptidkette, die einen Kopf bildet und dessen Schwanz keine alpha-helikalen Regionen aufweist. Während die Myosine I und V zwei Polypeptidketten aufweisen und daher zwei Köpfe und einen Schwanz bilden, in denen sich die helikalen Alpha-Ketten zu einer stabförmigen Struktur wickelten.
Die Myosine I und V haben Bindungsstellen für Calmodulin, das Ca reguliert und bindet+zwei, an leichten Ketten. Myosin I fixiert Ca.+zwei in leichten Ketten, aber anders als Calmodulin.
Eigenschaften
Auf mechanochemischer Ebene haben Myosine drei Eigenschaften, nämlich:
- Der Myosinkopf ist die motorische Domäne, die in diskreten Schritten voranschreitet: Die Vereinigung des Myosinkopfes mit einem Aktinfilament, seine Neigung und anschließende Trennung erzeugen die Bewegung von Myosin. Dieser Prozess ist zyklisch und hängt von ATP ab.
- Konforme Änderungen: Die Hydrolyse eines ATP-Moleküls ist über Amplifikations- und Transmissionsgrade an jeden Schritt eines Myosinmoleküls gekoppelt. Dies beinhaltet große Konformationsänderungen von Myosin..
Die erste Amplifikationsstufe wird durch den Verlust der Gamma-Phosphat-Gruppe von ATP erzeugt, was eine Reorganisation der Strukturelemente an der ATP-Bindungsstelle ermöglicht. Diese Reorganisation ist mit strukturellen Veränderungen an der Aktin-Bindungsstelle koordiniert..
Die zweite Amplifikationsstufe beinhaltet die Kommunikation der Konformationsänderung im aktiven Zentrum mit Strukturkomponenten des Carboxylterminals..
- Direktionalität: Es wurde festgestellt, dass Myosine eine Polarität oder eine umgekehrte Direktionalität zum (+) Ende des Aktinfilaments aufweisen. Diese Schlussfolgerung stammt aus den Actin-Filament-Slip-Experimenten unter Verwendung eines Fluoreszenzlichtmikroskops..
Eigenschaften
Myosin ist zusammen mit Actin unter anderem an der Muskelkontraktion, der Zelladhäsion, der Zytokinese, der Versteifung der kortikalen Membranen und der Verschiebung einiger Vesikel beteiligt..
Defekte in Myosin können zu pathologischen Zuständen führen. Beispielsweise hängen Defekte in Myosinen I und V mit Myosin-Myopathien bzw. Pigmentstörungen (Griscelli-Syndrom) zusammen. Während Störungen in Myosin VI-Isoformen zu Hörverlust führen.
Muskelkontraktion
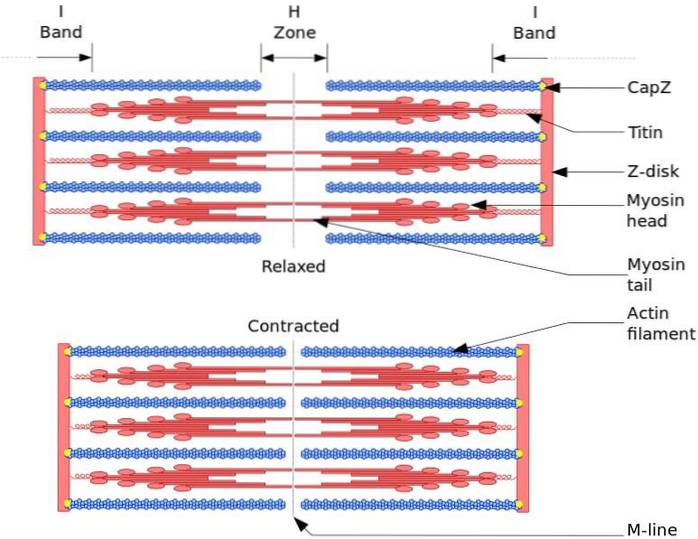
Die funktionelle und strukturelle Einheit des Skelettmuskels ist das Sarkomer. Während der Muskelkontraktion erreicht die Länge des Sarkomers 30% seiner ursprünglichen Länge.
Sarkomere bestehen aus dicken Myosinfilamenten und dünnen Aktinfilamenten, die auf komplexe Weise organisiert sind. Im Allgemeinen befinden sich die Myosinköpfe an den distalen Enden des Filaments und ihre Schwänze in Richtung der Mitte des Sarkomers, und die Organisation ist bipolar.
Damit eine Muskelkontraktion auftreten kann, müssen sich die Myosinköpfe an den gegenüberliegenden Enden in Richtung der Z-Scheibe oder des (+) Endes des Filaments bewegen. Da die Organisation der dicken Filamente bipolar ist, erfolgt das Gleiten der dünnen Filamente auf den dicken Filamenten, angetrieben durch ATP.
Die Verschiebungskraft tritt auf, weil Hunderte von Myosinköpfen eines dicken Filaments mit einem dünnen Filament interagieren.
Zytokinese
Während der Mitose bilden Actin und Myosin II einen kontraktilen Ring am Äquator der Zelle, wenn sich Mikrotubuli an den Spindelpolen trennen. Dieser Ring zieht sich zusammen, verringert seinen Durchmesser und teilt die Zelle in zwei Teile..
Versteifung der kortikalen Membranen
In mutierten Zellen, denen Myosin II fehlt, verformt sich die Plasmamembran leicht, wenn eine äußere Kraft angewendet wird. Dies geschieht, weil Myosin II den Plasmamembranproteinen eine Aggregationskraft verleiht..
Zelladhäsion
Im Epithelgewebe befinden sich die kontraktilen Bündel von Actin und Myosin II in der Nähe der Plasmamembran und bilden einen kreisförmigen Gürtel, der die innere Zelloberfläche umgibt. Dieser kreisförmige Gürtel bestimmt die Form der Zelle und hält die Bindung zwischen den Zellen aufrecht..
Der Kontakt zwischen Zellen erfolgt durch die Vereinigung des Kreisgürtels mit den zellulären Adhäsionsmolekülen mittels Vereinigungsproteinen.
Verschiebung einiger Vesikel
Experimentelle Beweise zeigen, dass Myosin V einen Membrantransport vom Golgi-Apparat zur Peripherie der Zelle durchführt. Einige Beweise sind:
- In Nervengewebezellen wurde durch Astrozyten-Immunfluoreszenz festgestellt, dass sich Myosin V neben dem Golgi befindet.
- In Hefen stören Mutationen im Myosin V-Gen die Proteinsekretion und folglich reichert sich Protein im Cytosol an.
- Die Myosin I-Isoformen sind für den Transport von Vakuolen zur Zellmembran verantwortlich. Unter Verwendung spezifischer Antikörper gegen Myosin I-Isoformen wurde gefunden, dass sich diese Isoformen in verschiedenen Teilen der Zelle befinden..
Wenn beispielsweise eine lebende Amöbe mit einem Antikörper gegen Myosin IC markiert ist, wird der Transport der Vakuole zur Membran gestoppt. Aufgrund dessen dehnt sich die Vakuole aus und die Zelle platzt.
Myosin-bedingte Krankheiten
Myosine und Hörverlust
Es gibt zahlreiche Gene und Mutationen, die zu Hörverlust führen. Diese Krankheit ist häufig monogenetisch .
Unkonventionelle Myosin-Mutationen mit einem oder zwei Myosinköpfen beeinträchtigen die Funktion des Innenohrs. Einige der mutierten Myosin-Isoformen sind Myosin IIIA, Myosin VIIA und Myosin XVA. Kürzlich wurden zwei Mutationen in Myosin VI entdeckt.
Mutationen in Myosin VI sind c.897G> T und p.926Q. Die erste Mutation betrifft eine Region, die mit dem aktiven Zentrum interagiert, genannt Switch I. Homozygot für die Mutation zeigt den Phänotyp früh und verursacht schwere Effekte.
Die zweite Mutation betrifft eine Region geladener Reste in einer Alpha-Helix im Schwanz von Myosin VI. Diese Region ist wichtig für die proximale motorische Dimerisierung und beeinflusst die Stereo-Ziliar-Funktion von Myosin VI..
Eine weitere Mutation ist p.Asn207Ser, die einen Motor erzeugt, der keine Kraft erzeugen kann. Dies liegt daran, dass Asn 207 ein Aminosäurerest des aktiven Zentrums ist, dessen Funktion die Bindung und Hydrolyse von ATP ist.
Die p.Arg657Trp-Mutation führt zum Verlust der Myosin-VI-Funktion. Der Arg-Rest ist an den Konformationsänderungen beteiligt, die die Hydrolyse mit der Bewegung von Myosin koppeln.
Myosin X und Krebs
Myosin X (Myo10) ist ein unkonventionelles Myosin, das im Gehirn, im Endothel und in vielen Epithelien exprimiert wird. Myo10 und drei Klassen aktinbasierter Projektionen (Filopodia-, Invadopodia- und Filopodia-ähnliche Projektionen) wirken während der Krebsmetastasierung.
Invasive Krebszellen weisen eine große Anzahl von Filopodien auf und exprimieren ein hohes Maß an Faszina. Dieses Protein macht Vernetzungen zwischen Aktinfilamenten. Um dem Primärtumor zu entkommen, werden Invadopodien gebildet, die reich an proteolytischer Aktivität sind und die umgebende extrazelluläre Matrix verdauen..
Sobald die Zellen die extrazelluläre Matrix erreichen, helfen die filopodienartigen Projektionen, sich zu zerstreuen und zu besiedeln. Hohe Myo10-Spiegel weisen auf eine hohe Aggressivität und Metastasierung bei Brustkrebs hin.
Die MyoX-Stummschaltung führt zum Verlust des metastatischen Charakters von Zellen, die keine aktinbasierten Projektionen bilden können. Alle diese Projektionen haben Adhäsionen auf Integrinbasis, die von Myo10 im Filopodium getragen werden..
MyoX ist an der Bildung des Zentrosoms beteiligt. Das Fehlen von MyoX begünstigt die Bildung multipolarer Spindeln. MyoX ist auch an der Signalübertragung in Krebszellen beteiligt. Zum Beispiel wird MyoX durch 3,4,5-Inositoltriphosphat (PIP3) aktiviert..
Verweise
- B. Alberts, A. Johnson, J. Lewis et al. 2007. Molekularbiologie der Zelle. Garland Science, New York.
- Brownstein, Z., Abu-Rayyan, A., Karfunkel-Doron, D., Sirigu, S., Davido, B., Shohat, M., Frydman, M., Houdusse, A., Kanaan, M., Avraham , K. 2014. Neuartige Myosin-Mutationen bei erblichem Hörverlust, die durch gezielte genomische Erfassung und massiv parallele Sequenzierung entdeckt wurden. European Journal of Human Genetics, 22: 768 & ndash; 775.
- Courson, D.S. und Cheney, R.E. 2015. Myosin-X und Krankheit. Experimental Cell Research, 334: 10 & ndash; 15.
- H. Lodish, A. Berk, S. L. Zipurski, P. Matsudaria, D. Baltimore, J. Darnell, 2003. Zell- und Molekularbiologie. Editorial Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexiko, Sāo Paulo.
- Schliwa, M. und Woehlke, G. 2003. Molekularmotoren. Nature, 422: 759 & ndash; 765.
- Okay, R.D. 2003. Die Molecular Motor Toolbox für den intrazellulären Transport. Cell, 112: 467 & ndash; 480.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.