
Top 6 Faktoren, die die Löslichkeit beeinflussen
Main Faktoren, die die Löslichkeit beeinflussen Sie sind Polarität, gemeinsamer Ioneneffekt, Temperatur, Druck, Art des gelösten Stoffes und mechanische Faktoren. Löslichkeit ist die Fähigkeit einer festen, flüssigen oder gasförmigen Chemikalie (als gelöster Stoff bezeichnet), sich in einem Lösungsmittel (normalerweise einer Flüssigkeit) zu lösen und eine Lösung zu bilden..
Die Löslichkeit einer Substanz hängt hauptsächlich vom verwendeten Lösungsmittel sowie von Temperatur und Druck ab. Die Löslichkeit einer Substanz in einem bestimmten Lösungsmittel wird durch die Konzentration der gesättigten Lösung gemessen.

Eine Lösung gilt als gesättigt, wenn die Zugabe eines zusätzlichen gelösten Stoffes die Konzentration der Lösung nicht mehr erhöht..
Der Löslichkeitsgrad variiert stark in Abhängigkeit von den Substanzen, von unendlich löslich (vollständig mischbar) wie Ethanol in Wasser bis schwer löslich wie Silberchlorid in Wasser. Der Begriff "unlöslich" wird häufig auf schwerlösliche Verbindungen angewendet (Boundless, S.F.).
Bestimmte Substanzen sind in allen Anteilen mit einem bestimmten Lösungsmittel löslich, wie Ethanol in Wasser. Diese Eigenschaft wird als Mischbarkeit bezeichnet.
Unter verschiedenen Bedingungen kann die Gleichgewichtslöslichkeit überschritten werden, um eine sogenannte übersättigte Lösung zu ergeben (Solubility, S.F.).
Hauptfaktoren, die die Löslichkeit beeinflussen
1- Polarität
In den meisten Fällen lösen sich gelöste Stoffe in Lösungsmitteln mit ähnlicher Polarität. Chemiker verwenden einen populären Aphorismus, um diese Eigenschaft von gelösten Stoffen und Lösungsmitteln zu beschreiben: "Gleiches löst Gleiches auf".
Unpolare gelöste Stoffe lösen sich nicht in polaren Lösungsmitteln und umgekehrt (Educating online, S.F.).
2- Wirkung des gemeinsamen Ions
Der übliche Ioneneffekt ist ein Begriff, der die Abnahme der Löslichkeit einer ionischen Verbindung beschreibt, wenn dem Gemisch ein Salz zugesetzt wird, das ein Ion enthält, das bereits im chemischen Gleichgewicht vorliegt..
Dieser Effekt lässt sich am besten durch das Prinzip von Le Châtelier erklären. Stellen Sie sich vor, die schwerlösliche ionische Verbindung Calciumsulfat CaSO4, wird dem Wasser zugesetzt. Die Nettoionengleichung für das resultierende chemische Gleichgewicht lautet wie folgt:
CaSO4 (s) ⇌Ca2 + (aq) + SO42 - (aq)
Calciumsulfat ist schwer löslich. Im Gleichgewicht liegt der größte Teil des Calciums und Sulfats in fester Form von Calciumsulfat vor..
Angenommen, die lösliche ionische Verbindung Kupfersulfat (CuSO)4) wurde zu der Lösung gegeben. Kupfersulfat ist löslich; Daher ist die einzige wesentliche Auswirkung auf die Nettoionengleichung die Zugabe von mehr Sulfationen (SO)4zwei-).
CuSO4 (s) ⇌Cu2 + (aq) + SO42 - (aq)
Von Kupfersulfat dissoziierte Sulfationen sind bereits in der Mischung aufgrund der leichten Dissoziation von Calciumsulfat vorhanden (gemeinsam).
Daher unterstreicht diese Zugabe von Sulfationen das zuvor hergestellte Gleichgewicht.
Das Prinzip von Le Chatelier schreibt vor, dass die zusätzliche Spannung auf dieser Seite des Gleichgewichtsprodukts zu einer Verschiebung des Gleichgewichts in Richtung der Reaktantenseite führt, um diese neue Spannung abzubauen..
Aufgrund der Verschiebung zur Reaktantenseite wird die Löslichkeit von schwerlöslichem Calciumsulfat weiter verringert (Erica Tran, 2016).
3- Temperatur
Die Temperatur wirkt sich direkt auf die Löslichkeit aus. Bei den meisten ionischen Feststoffen erhöht sich durch Erhöhen der Temperatur, wie schnell die Lösung hergestellt werden kann.
Mit steigender Temperatur bewegen sich die Partikel des Feststoffs schneller, was die Wahrscheinlichkeit erhöht, dass sie mit mehr Partikeln des Lösungsmittels interagieren. Dies führt zu einer Erhöhung der Geschwindigkeit, mit der eine Lösung hergestellt wird..
Die Temperatur kann auch die Menge an gelöstem Stoff erhöhen, die in einem Lösungsmittel gelöst werden kann. Im Allgemeinen lösen sich mit steigender Temperatur mehr gelöste Partikel auf.
Zum Beispiel ist das Hinzufügen von Haushaltszucker zu Wasser eine einfache Methode, um eine Lösung herzustellen. Wenn diese Lösung erhitzt und Zucker hinzugefügt wird, wird festgestellt, dass große Mengen Zucker hinzugefügt werden können, wenn die Temperatur weiter ansteigt..
Der Grund dafür ist, dass mit steigender Temperatur die intermolekularen Kräfte leichter brechen können, wodurch mehr gelöste Partikel von den Lösungsmittelpartikeln angezogen werden können..
Es gibt jedoch andere Beispiele, bei denen eine Erhöhung der Temperatur nur einen geringen Einfluss darauf hat, wie viel gelöster Stoff gelöst werden kann..
Speisesalz ist ein gutes Beispiel: Sie können fast die gleiche Menge Speisesalz in Eiswasser lösen wie in kochendem Wasser..
Bei allen Gasen nimmt die Löslichkeit mit steigender Temperatur ab. Die kinetische Molekulartheorie kann verwendet werden, um dieses Phänomen zu erklären..
Mit steigender Temperatur bewegen sich die Gasmoleküle schneller und können aus der Flüssigkeit entweichen. Die Gaslöslichkeit nimmt dann ab.
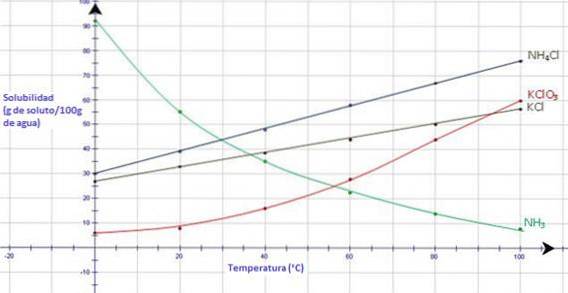
In der folgenden Grafik zeigt Ammoniakgas NH3 eine starke Abnahme der Löslichkeit mit steigender Temperatur, während alle ionischen Feststoffe eine Zunahme der Löslichkeit mit steigender Temperatur zeigen (CK-12 Foundation, S.F.).
4- Druck
Der zweite Faktor, der Druck, beeinflusst die Löslichkeit eines Gases in einer Flüssigkeit, jedoch niemals eines Feststoffs, der sich in einer Flüssigkeit löst..
Wenn Druck auf ein Gas ausgeübt wird, das sich über der Oberfläche eines Lösungsmittels befindet, bewegt sich das Gas in das Lösungsmittel und nimmt einen Teil der Räume zwischen den Lösungsmittelpartikeln ein..
Ein gutes Beispiel ist kohlensäurehaltiges Soda. Es wird Druck ausgeübt, um die CO2-Moleküle in die Soda zu drücken. Das Gegenteil ist auch der Fall. Wenn der Druck des Gases abnimmt, nimmt auch die Löslichkeit dieses Gases ab.
Wenn eine Getränkedose geöffnet wird, sinkt der Druck in der Getränkedose, sodass das Gas sofort aus der Lösung austritt.
In der Soda gespeichertes Kohlendioxid wird freigesetzt, und Sie können das Sprudeln auf der Oberfläche der Flüssigkeit sehen. Wenn Sie eine offene Dose Soda für einen bestimmten Zeitraum stehen lassen, stellen Sie möglicherweise fest, dass das Getränk aufgrund des Kohlendioxidverlusts flach wird.
Dieser Gasdruckfaktor wird im Henryschen Gesetz ausgedrückt. Das Henry-Gesetz besagt, dass bei einer gegebenen Temperatur die Löslichkeit eines Gases in einer Flüssigkeit proportional zum Partialdruck des Gases über der Flüssigkeit ist.
Ein Beispiel für Henrys Gesetz ist das Tauchen. Wenn eine Person in tiefes Wasser taucht, steigt der Druck und mehr Gase lösen sich im Blut auf.
Während des Tauchens aus einem Tiefwassertauchgang muss der Taucher mit sehr langsamer Geschwindigkeit an die Wasseroberfläche zurückkehren, damit alle gelösten Gase das Blut sehr langsam verlassen können.
Wenn eine Person zu schnell aufsteigt, kann ein medizinischer Notfall auftreten, weil Gase das Blut zu schnell verlassen (Papapodcasts, 2010)..
5- Art des gelösten Stoffes
Die Art des gelösten Stoffes und des Lösungsmittels sowie das Vorhandensein anderer chemischer Verbindungen in der Lösung beeinflussen die Löslichkeit..
Zum Beispiel kann mehr Zucker in Wasser gelöst werden als Salz in Wasser. In diesem Fall wird gesagt, dass Zucker löslicher ist.
Ethanol in Wasser ist vollständig miteinander löslich. In diesem speziellen Fall ist das Lösungsmittel die Verbindung, die in der größten Menge gefunden wird.
Die Größe des gelösten Stoffes ist ebenfalls ein wichtiger Faktor. Je größer die gelösten Moleküle sind, desto größer ist ihr Molekulargewicht und ihre Größe. Für Lösungsmittelmoleküle ist es schwieriger, größere Moleküle zu umgeben.
Wenn alle oben genannten Faktoren ausgeschlossen werden, kann eine allgemeine Faustregel gefunden werden, dass größere Partikel im Allgemeinen weniger löslich sind..
Wenn der Druck und die Temperatur gleich sind wie zwischen zwei gelösten Stoffen gleicher Polarität, ist derjenige mit kleineren Partikeln normalerweise löslicher (Faktoren, die die Löslichkeit beeinflussen, S.F.).
6- mechanische Faktoren
Im Gegensatz zu der Auflösungsrate, die hauptsächlich von der Temperatur abhängt, hängt die Rekristallisationsrate von der Konzentration des gelösten Stoffes auf der Oberfläche des Kristallgitters ab, die bevorzugt wird, wenn eine Lösung unbeweglich ist.
Daher verhindert das Rühren der Lösung diese Akkumulation, wodurch die Auflösung maximiert wird. (Sättigungstipps, 2014).
Verweise
- (S.F.). Löslichkeit. Von boundles.com wiederhergestellt.
- CK-12-Stiftung. (S.F.). Faktoren, die die Löslichkeit beeinflussen. Von ck12.org wiederhergestellt.
- Online lernen. (S.F.). Faktoren, die die Löslichkeit beeinflussen. Von solubilityofthings.com wiederhergestellt.
- Erica Tran, D. L. (2016, 28. November). Löslichkeit und Faktoren, die die Löslichkeit beeinflussen. Von chem.libretexts.org wiederhergestellt.
- Faktoren, die die Löslichkeit beeinflussen. (S.F.). Von sciencesource.pearsoncanada.ca wiederhergestellt.
- (2010, 1. März). Faktoren, die die Löslichkeit beeinflussen Teil 4. Von youtube.com wiederhergestellt.
- Löslichkeit. (S.F.). Von chemed.chem.purdue.ed wiederhergestellt.
- Sättigungsspitzen. (2014, 26. Juni). Von Chemie libretex.org wiederhergestellt.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.