
Henry-Gesetz Gleichung, Abweichung, Anwendungen
Das Henrys Gesetz gibt an, dass bei einer konstanten Temperatur die in einer Flüssigkeit gelöste Gasmenge direkt proportional zu ihrem Partialdruck auf der Oberfläche der Flüssigkeit ist.
Es wurde 1803 vom englischen Physiker und Chemiker William Henry postuliert. Sein Gesetz kann auch so interpretiert werden: Wenn der Druck auf die Flüssigkeit erhöht wird, ist die Menge des darin gelösten Gases umso größer..

Hier wird das Gas als gelöster Stoff der Lösung betrachtet. Im Gegensatz zu festen gelösten Stoffen wirkt sich die Temperatur negativ auf die Löslichkeit aus. Mit zunehmender Temperatur neigt das Gas daher dazu, leichter aus der Flüssigkeit zur Oberfläche zu entweichen..
Dies liegt daran, dass der Temperaturanstieg Energie zu den gasförmigen Molekülen beiträgt, die miteinander kollidieren und Blasen bilden (oberes Bild). Diese Blasen überwinden dann den äußeren Druck und entweichen aus dem Sinus der Flüssigkeit..
Wenn der Außendruck sehr hoch ist und die Flüssigkeit kalt gehalten wird, lösen sich die Blasen auf und nur wenige gasförmige Moleküle "schweben" auf der Oberfläche.
Artikelverzeichnis
- 1 Henry-Gesetz-Gleichung
- 2 Abweichung
- 3 Löslichkeit eines Gases in der Flüssigkeit
- 3.1 Ungesättigt
- 3.2 Gesättigt
- 3.3 übersättigt
- 4 Anwendungen
- 5 Beispiele
- 6 Referenzen
Henry's Law Equation
Es kann durch die folgende Gleichung ausgedrückt werden:
P = K.H.∙ C.
Wobei P der Partialdruck des gelösten Gases ist; C ist die Gaskonzentration; und K.H. ist Henrys Konstante.
Es ist zu verstehen, dass der Partialdruck eines Gases derjenige ist, der individuell von einer Spezies des Restes des gesamten Gasgemisches ausgeübt wird. Und der Gesamtdruck ist nichts anderes als die Summe aller Partialdrücke (Daltonsches Gesetz):
P.Gesamt= P.1 + P.zwei + P.3+… + P.n
Die Anzahl der gasförmigen Spezies, aus denen die Mischung besteht, wird durch dargestellt n. Wenn sich beispielsweise auf der Oberfläche einer Flüssigkeit Wasserdampf und CO befindenzwei, n gleich 2.
Abweichung
Für in Flüssigkeiten schwer lösliche Gase ist die Lösung nahezu ideal und entspricht dem Henryschen Gesetz für den gelösten Stoff.
Wenn der Druck jedoch hoch ist, gibt es eine Abweichung in Bezug auf Henry, da sich die Lösung nicht mehr wie eine ideale Verdünnung verhält.
Was bedeutet das? Diese Wechselwirkungen zwischen gelösten Stoffen und gelösten Stoffen beginnen ihre eigenen Wirkungen zu haben. Wenn die Lösung sehr verdünnt ist, sind die Gasmoleküle „ausschließlich“ von Lösungsmittel umgeben, wobei mögliche Begegnungen untereinander vernachlässigt werden..
Wenn die Lösung nicht mehr ideal verdünnt ist, wird daher der Verlust des linearen Verhaltens im P-Diagramm beobachtetich vs X.ich.
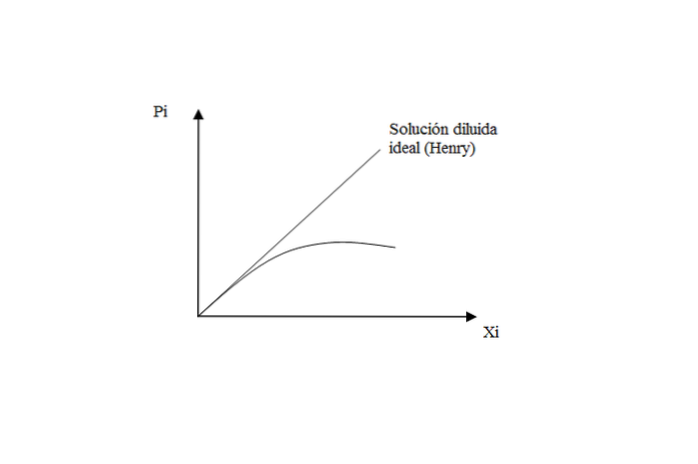
Fazit zu diesem Aspekt: Das Henry-Gesetz bestimmt den Dampfdruck eines gelösten Stoffes in einer idealen verdünnten Lösung. Während für das Lösungsmittel gilt das Gesetz von Raoult:
P.ZU = X.ZU∙ P.ZU* *
Löslichkeit eines Gases in der Flüssigkeit

Wenn ein Gas in einer Flüssigkeit wie Zucker in Wasser gut gelöst ist, kann es nicht von der Umgebung unterschieden werden, wodurch eine homogene Lösung entsteht. Mit anderen Worten: In der Flüssigkeit (oder den Zuckerkristallen) werden keine Blasen beobachtet..
Die effiziente Solvatisierung gasförmiger Moleküle hängt jedoch von einigen Variablen ab, wie z. B.: Der Temperatur der Flüssigkeit, dem Druck, der sie beeinflusst, und der chemischen Natur dieser Moleküle im Vergleich zu denen der Flüssigkeit..
Wenn der Außendruck zu hoch ist, erhöht sich die Wahrscheinlichkeit, dass Gas in die Flüssigkeitsoberfläche eindringt. Andererseits fällt es den gelösten Gasmolekülen schwerer, den einfallenden Druck zu überwinden, um nach außen zu entweichen..
Wenn das Flüssiggassystem bewegt wird (wie es im Meer und in den Luftpumpen im Aquarium auftritt), wird die Absorption von Gas begünstigt.
Und wie wirkt sich die Art des Lösungsmittels auf die Absorption eines Gases aus? Wenn es wie Wasser polar ist, zeigt es eine Affinität zu polaren gelösten Stoffen, dh zu Gasen, die ein permanentes Dipolmoment haben. Wenn es unpolar ist, wie Kohlenwasserstoffe oder Fette, bevorzugt es unpolare gasförmige Moleküle
Zum Beispiel Ammoniak (NH3) ist aufgrund von Wasserstoffbrückenbindungen ein in Wasser sehr lösliches Gas. Während Wasserstoff (H.zwei), dessen kleines Molekül unpolar ist, interagiert schwach mit Wasser.
Abhängig vom Zustand des Gasabsorptionsprozesses in der Flüssigkeit können auch die folgenden Zustände in ihnen hergestellt werden:
Ungesättigt
Die Flüssigkeit ist ungesättigt, wenn sie mehr Gas lösen kann. Dies liegt daran, dass der Außendruck höher ist als der Innendruck der Flüssigkeit..
Gesättigt
Die Flüssigkeit stellt ein Gleichgewicht in der Löslichkeit des Gases her, was bedeutet, dass das Gas mit der gleichen Geschwindigkeit entweicht, mit der es in die Flüssigkeit eindringt..
Es kann auch folgendermaßen gesehen werden: Wenn drei gasförmige Moleküle in die Luft entweichen, kehren drei weitere gleichzeitig in die Flüssigkeit zurück.
Übersättigt
Die Flüssigkeit ist mit Gas übersättigt, wenn ihr Innendruck höher als der Außendruck ist. Und mit einer minimalen Änderung im System wird überschüssiges gelöstes Gas freigesetzt, bis das Gleichgewicht wiederhergestellt ist.
Anwendungen
- Das Henry-Gesetz kann angewendet werden, um Absorptionsberechnungen von Inertgasen (Stickstoff, Helium, Argon usw.) in den verschiedenen Geweben des menschlichen Körpers durchzuführen, die zusammen mit Haldanes Theorie die Grundlage für die Dekompressionstabellen bilden.
- Eine wichtige Anwendung ist die Blutgassättigung. Wenn das Blut ungesättigt ist, löst sich das Gas darin auf, bis es gesättigt wird und sich nicht mehr weiter auflöst. Sobald dies geschieht, gelangt das im Blut gelöste Gas in die Luft..
- Die Vergasung von Erfrischungsgetränken ist ein Beispiel für das angewandte Henry-Gesetz. Erfrischungsgetränke haben COzwei unter hohem Druck gelöst, wodurch jede der kombinierten Komponenten, aus denen es besteht, erhalten bleibt; und außerdem bewahrt es den charakteristischen Geschmack viel länger.
Wenn die Soda-Flasche nicht verschlossen ist, nimmt der Druck über der Flüssigkeit ab und der Druck wird sofort abgelassen.
Da der Druck auf die Flüssigkeit nun geringer ist, ist die Löslichkeit von COzwei steigt ab und entkommt in die Umwelt (kann im Aufsteigen der Blasen von unten gesehen werden).

- Wenn ein Taucher in größere Tiefen abtaucht, kann inhalierter Stickstoff nicht entweichen, da er durch äußeren Druck verhindert wird und sich im Blut des Individuums auflöst.
Wenn der Taucher schnell an die Oberfläche steigt, wo der Außendruck wieder abfällt, beginnt Stickstoff ins Blut zu sprudeln..
Dies führt zu einer sogenannten Dekompressionskrankheit. Aus diesem Grund müssen Taucher langsam aufsteigen, damit Stickstoff langsamer aus dem Blut entweicht..
- Untersuchung der Auswirkungen der Abnahme des molekularen Sauerstoffs (O.zwei) gelöst im Blut und Gewebe von Bergsteigern oder Praktikern von Aktivitäten, die einen längeren Aufenthalt in großen Höhen beinhalten, sowie in den Bewohnern ziemlich hoher Orte.
- Erforschung und Verbesserung der Methoden zur Vermeidung von Naturkatastrophen, die durch das Vorhandensein gelöster Gase in riesigen Gewässern verursacht werden können, die gewaltsam freigesetzt werden können.
Beispiele
Das Henry-Gesetz gilt nur, wenn sich die Moleküle im Gleichgewicht befinden. Hier sind einige Beispiele:
- In gelöstem Sauerstoff (O.zwei) in Blutflüssigkeit wird dieses Molekül als in Wasser schwer löslich angesehen, obwohl seine Löslichkeit durch den hohen Gehalt an Hämoglobin in ihm stark erhöht wird. Somit kann jedes Hämoglobinmolekül an vier Sauerstoffmoleküle binden, die in den Geweben freigesetzt werden, um im Stoffwechsel verwendet zu werden.
- 1986 wurde eine dicke Kohlendioxidwolke registriert, die plötzlich aus dem Nyos-See (in Kamerun) ausgestoßen wurde und ungefähr 1700 Menschen und eine große Anzahl von Tieren erstickte, was durch dieses Gesetz erklärt wurde.
- Die Löslichkeit, die ein gegebenes Gas in einer flüssigen Spezies manifestiert, neigt dazu, mit zunehmendem Druck des Gases zuzunehmen, obwohl es bei hohen Drücken bestimmte Ausnahmen gibt, wie beispielsweise Stickstoffmoleküle (N.zwei).
- Das Henry-Gesetz ist nicht anwendbar, wenn eine chemische Reaktion zwischen der Substanz, die als gelöster Stoff wirkt, und der Substanz, die als Lösungsmittel wirkt, besteht. Dies ist der Fall bei Elektrolyten wie Salzsäure (HCl)..
Verweise
- Crockford, H. D., Knight Samuel B. (1974). Grundlagen der Physikochemie. (6. Aufl.). Editorial C.E.C.S.A., Mexiko. P 111-119.
- Die Herausgeber der Encyclopaedia Britannica. (2018). Henrys Gesetz. Abgerufen am 10. Mai 2018 von: britannica.com
- Byjus. (2018). Was ist Henrys Gesetz? Abgerufen am 10. Mai 2018 von: byjus.com
- Leisurepro & Aquaviews. (2018). Henry's Law Abgerufen am 10. Mai 2018 von: leisurepro.com
- Annenberg-Stiftung. (2017). Abschnitt 7: Henrys Gesetz. Abgerufen am 10. Mai 2018 von: learner.org
- Monica Gonzalez. (25. April 2011). Henrys Gesetz. Abgerufen am 10. Mai 2018 von: quimica.laguia2000.com
- Ian Myles. (24. Juli 2009). Taucher. [Zahl]. Abgerufen am 10. Mai 2018 von: flickr.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.