
Gesetz der Massenaktionsanwendungen, Beispiele
Das Gesetz der Massenaktion stellt die Beziehung zwischen den aktiven Massen der Reaktanten und der der Produkte unter Gleichgewichtsbedingungen und in homogenen Systemen (Lösungen oder Gasphasen) her. Es wurde von norwegischen Wissenschaftlern C.M. Guldberg und P. Waage, die erkannten, dass das Gleichgewicht dynamisch und nicht statisch ist.
Warum dynamisch? Weil die Raten der Vorwärts- und Rückwärtsreaktionen gleich sind. Aktive Massen werden üblicherweise in mol / l (Molarität) ausgedrückt. Eine solche Reaktion kann folgendermaßen geschrieben werden: aA + bB <=> cC + dD. Für das in diesem Beispiel erwähnte Gleichgewicht ist die Beziehung zwischen Reaktanten und Produkten in der Gleichung im folgenden Bild dargestellt.
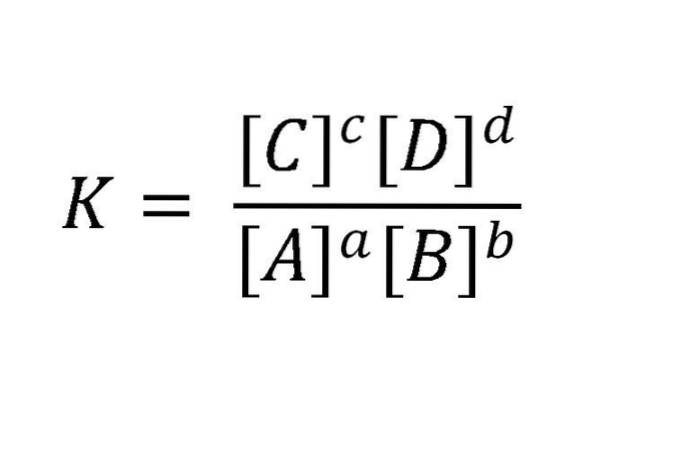
K ist unabhängig von den Anfangskonzentrationen der Substanzen immer konstant, solange die Temperatur nicht variiert. Hier sind A, B, C und D die Reaktanten und Produkte; während a, b, c und d ihre stöchiometrischen Koeffizienten sind.
Der numerische Wert von K ist eine charakteristische Konstante für jede Reaktion bei einer gegebenen Temperatur. Dann ist K die sogenannte Gleichgewichtskonstante.
Die Notation [] bedeutet, dass im mathematischen Ausdruck die Konzentrationen in Einheiten von mol / l erscheinen, die auf eine Potenz angehoben werden, die dem Reaktionskoeffizienten entspricht.
Artikelverzeichnis
- 1 Was ist das Gesetz der Massenaktion??
- 1.1 Bedeutung der Gleichgewichtskonstante
- 2 Chemisches Gleichgewicht
- 2.1 Gleichgewicht in heterogenen Systemen
- 2.2 Gleichgewichtsverschiebungen
- 3 Das Prinzip von Le Chatelier
- 4 Anwendungen
- 5 Beispiele des Massenaktionsgesetzes
- 6 Das Gesetz der Massenaktion in der Pharmakologie
- 7 Einschränkungen
- 8 Referenzen
Was ist das Gesetz der Massenaktion?
Wie zuvor erwähnt, drückt das Massenwirkungsgesetz aus, dass die Geschwindigkeit einer gegebenen Reaktion direkt proportional zum Produkt der Konzentrationen der Reaktantenspezies ist, wobei die Konzentration jeder Spezies auf eine Leistung erhöht wird, die ihrem stöchiometrischen Koeffizienten in der Chemikalie entspricht Gleichung.
In diesem Sinne kann dies besser durch eine reversible Reaktion erklärt werden, deren allgemeine Gleichung nachstehend dargestellt ist:
aA + bB ↔ cC + dD
Wobei A und B die Reaktanten darstellen und die mit C und D bezeichneten Substanzen die Reaktionsprodukte darstellen. Ebenso repräsentieren die Werte von a, b, c und d die stöchiometrischen Koeffizienten von A, B, C bzw. D..
Ausgehend von der vorherigen Gleichung wird die zuvor erwähnte Gleichgewichtskonstante erhalten, die wie folgt dargestellt ist:
K = [C]c[D]d/[ZU]zu[B]b
Wenn die Gleichgewichtskonstante K gleich einem Quotienten ist, besteht der Zähler aus der Multiplikation der Konzentrationen der Produkte (im Gleichgewichtszustand), die in der ausgeglichenen Gleichung auf ihren Koeffizienten angehoben wurden, und der Nenner besteht aus einer ähnlichen Multiplikation, aber unter die Reaktanten erhöhten sich auf den sie begleitenden Koeffizienten.
Bedeutung der Gleichgewichtskonstante
Es ist zu beachten, dass in der Gleichung zur Berechnung der Gleichgewichtskonstante die Konzentrationen der Spezies im Gleichgewicht verwendet werden müssen, solange keine Änderungen an diesen oder an der Temperatur des Systems vorgenommen werden..
In gleicher Weise liefert der Wert der Gleichgewichtskonstante Informationen über die Richtung, die bei einer Reaktion im Gleichgewicht bevorzugt wird, dh er zeigt, ob die Reaktion gegenüber den Reaktanten oder den Produkten günstig ist..
Wenn die Größe dieser Konstante viel größer als Eins (K "1) ist, verschiebt sich das Gleichgewicht nach rechts und begünstigt die Produkte, während wenn die Größe dieser Konstante viel kleiner als Einheit (K" 1) ist, das Gleichgewicht wird nach links geneigt sein und die Reaktanten begünstigen.
Auch wenn durch Konvention angegeben wird, dass die Substanzen auf der linken Seite des Pfeils die Reaktanten und diejenigen auf der rechten Seite die Produkte sind, wird die Tatsache, dass die Reaktanten, die aus der Reaktion im direkten Sinne stammen, die Produkte in der Reaktion werden umgekehrt und umgekehrt.
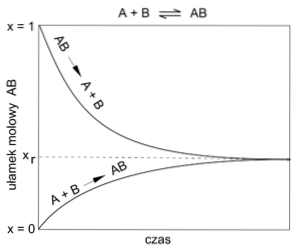
Chemisches Gleichgewicht
Reaktionen erreichen oft ein Gleichgewicht zwischen den Mengen an Ausgangssubstanzen und denen der gebildeten Produkte. Dieses Gleichgewicht kann sich zusätzlich verschieben und die Zunahme oder Abnahme einer der an der Reaktion beteiligten Substanzen begünstigen..
Eine analoge Tatsache tritt bei der Dissoziation einer gelösten Substanz auf: Während einer Reaktion kann das Verschwinden der Ausgangssubstanzen und die Bildung der Produkte experimentell mit variabler Geschwindigkeit beobachtet werden.
Die Reaktionsgeschwindigkeit hängt stark von der Temperatur und in unterschiedlichem Maße von der Konzentration der Reaktanten ab. Tatsächlich werden diese Faktoren insbesondere durch chemische Kinetik untersucht.
Dieses Gleichgewicht ist jedoch nicht statisch, sondern beruht auf der Koexistenz einer direkten und einer inversen Reaktion..
Bei der direkten Reaktion (->) entstehen die Produkte, bei der inversen Reaktion (->)<-) estos vuelven a originar las sustancias iniciales.
Das Obige stellt das oben erwähnte sogenannte dynamische Gleichgewicht dar..
Gleichgewicht in heterogenen Systemen
In heterogenen Systemen - das heißt in solchen, die aus mehreren Phasen bestehen - können die Konzentrationen der Feststoffe als konstant angesehen werden, wobei der mathematische Ausdruck für K weggelassen wird.
Dieb3(s) <=> CaO (s) + COzwei(G)
Somit können im Zersetzungsgleichgewicht von Calciumcarbonat seine Konzentration und die des resultierenden Oxids unabhängig von seiner Masse als konstant angesehen werden..
Balance verschiebt sich
Der numerische Wert der Gleichgewichtskonstante bestimmt, ob eine Reaktion die Bildung von Produkten begünstigt oder nicht. Wenn K größer als 1 ist, hat das Gleichgewichtssystem eine höhere Konzentration an Produkten als an Reaktanten, und wenn K kleiner als 1 ist, tritt das Gegenteil auf: Im Gleichgewicht gibt es eine größere Konzentration an Reaktanten als an Produkten..
Le Chatelier-Prinzip
Der Einfluss von Konzentrations-, Temperatur- und Druckschwankungen kann die Reaktionsgeschwindigkeit verändern.
Wenn beispielsweise bei einer Reaktion gasförmige Produkte gebildet werden, bewirkt ein Druckanstieg über das System, dass die Reaktion in die entgegengesetzte Richtung (in Richtung der Reaktanten) läuft..
Im Allgemeinen sind die anorganischen Reaktionen, die zwischen Ionen stattfinden, sehr schnell, während die organischen Reaktionen viel niedrigere Geschwindigkeiten aufweisen..
Wenn bei einer Reaktion Wärme erzeugt wird, tendiert ein Anstieg der Außentemperatur dazu, sie in die entgegengesetzte Richtung zu orientieren, da die Rückreaktion endotherm ist (Wärme absorbiert)..
Wenn ein Überschuss in einer der reagierenden Substanzen innerhalb eines Systems im Gleichgewicht verursacht wird, bilden die anderen Substanzen ebenfalls Produkte, um diese Modifikation so weit wie möglich zu neutralisieren..
Infolgedessen verschiebt sich das Gleichgewicht durch Erhöhen der Reaktionsgeschwindigkeit in die eine oder andere Richtung, so dass der Wert von K konstant bleibt..
All diese äußeren Einflüsse und die Gleichgewichtsreaktion, um ihnen entgegenzuwirken, ist das sogenannte Le Chatelier-Prinzip..
Anwendungen
Trotz seines enormen Nutzens hatte dieses Gesetz, als es vorgeschlagen wurde, nicht die gewünschte Wirkung oder Relevanz in der wissenschaftlichen Gemeinschaft.
Ab dem 20. Jahrhundert erlangte es jedoch Bekanntheit, da die britischen Wissenschaftler William Esson und Vernon Harcourt es einige Jahrzehnte nach seiner Verkündung wieder aufnahmen..
Das Gesetz der Massenaktion hat im Laufe der Zeit viele Anwendungen gefunden, von denen einige nachstehend aufgeführt sind:
- Da es eher nach Aktivitäten als nach Konzentrationen formuliert ist, ist es nützlich, Abweichungen vom idealen Verhalten der Reaktanten in einer Lösung zu bestimmen, sofern dies mit der Thermodynamik übereinstimmt..
- Wenn sich eine Reaktion dem Gleichgewicht nähert, kann die Beziehung zwischen der Nettorate der Reaktion und der momentanen freien Gibbs-Energie einer Reaktion vorhergesagt werden..
- In Kombination mit dem detaillierten Gleichgewichtsprinzip liefert dieses Gesetz allgemein die resultierenden thermodynamischen Werte der Aktivitäten und der Konstanten im Gleichgewichtszustand sowie die Beziehung zwischen diesen und den resultierenden Geschwindigkeitskonstanten der Reaktionen im Vorwärtsbereich und umgekehrte Richtungen.
- Wenn die Reaktionen vom Elementartyp sind, erhalten wir durch Anwendung dieses Gesetzes die geeignete Gleichgewichtsgleichung für eine bestimmte chemische Reaktion und die Ausdrücke ihrer Geschwindigkeit.
Beispiele für das Gesetz der Massenaktion
-Bei der Untersuchung einer irreversiblen Reaktion zwischen in Lösung gefundenen Ionen führt der allgemeine Ausdruck dieses Gesetzes zur Brönsted-Bjerrum-Formulierung, die die Beziehung zwischen der Ionenstärke der Spezies und der Geschwindigkeitskonstante herstellt.
-Bei der Analyse der Reaktionen, die in verdünnten idealen Lösungen oder in einem Zustand gasförmiger Aggregation durchgeführt werden, wird der allgemeine Ausdruck des ursprünglichen Gesetzes (Jahrzehnt der 80er Jahre) erhalten.
-Da es universelle Eigenschaften hat, kann der allgemeine Ausdruck dieses Gesetzes als Teil der Kinetik verwendet werden, anstatt es als Teil der Thermodynamik zu betrachten.
-Bei Verwendung in der Elektronik wird dieses Gesetz verwendet, um zu bestimmen, dass die Multiplikation zwischen den Dichten der Löcher und den Elektronen einer gegebenen Oberfläche im Gleichgewichtszustand eine konstante Größe aufweist, selbst unabhängig von der Dotierung, die dem Material zugeführt wird..
-Die Verwendung dieses Gesetzes zur Beschreibung der Dynamik zwischen Raubtieren und Beute ist allgemein bekannt, vorausgesetzt, dass die Raubtierbeziehung auf der Beute ein gewisses Verhältnis zur Beziehung zwischen Raubtieren und Beute aufweist..
-Im Bereich der Gesundheitsstudien kann dieses Gesetz sogar angewendet werden, um bestimmte Faktoren des menschlichen Verhaltens aus politischer und sozialer Sicht zu beschreiben.
Das Gesetz der Massenaktion in der Pharmakologie
Unter der Annahme, dass D das Medikament und R der Rezeptor ist, auf den es wirkt, reagieren beide, um den DR-Komplex zu bilden, der für die pharmakologische Wirkung verantwortlich ist:
K = [DR] / [D] [R]
K ist die Dissoziationskonstante. Es gibt eine direkte Reaktion, bei der das Arzneimittel auf den Rezeptor wirkt, und eine andere, bei der der DR-Komplex in die ursprünglichen Verbindungen dissoziiert. Jede Reaktion hat ihre eigene Geschwindigkeit, die sich nur im Gleichgewicht befindet und K erfüllt.
Wenn man das Massengesetz auf den Buchstaben interpretiert, ist die Konzentration des gebildeten DR-Komplexes umso höher, je höher die Konzentration von D ist..
Die Gesamtzahl der Rt-Empfänger hat jedoch eine physikalische Grenze, sodass für alle verfügbaren D keine unbegrenzte Menge an R vorhanden ist. Ebenso haben experimentelle Studien auf dem Gebiet der Pharmakologie die folgenden Einschränkungen des Massengesetzes auf diesem Gebiet festgestellt:
- Es wird davon ausgegangen, dass die R-D-Bindung reversibel ist, in den meisten Fällen jedoch nicht..
- Die R-D-Bindung kann jede der beiden Komponenten (das Arzneimittel oder den Rezeptor) strukturell verändern, ein Umstand, der das Massengesetz nicht berücksichtigt.
- Darüber hinaus verblasst das Massengesetz angesichts von Reaktionen, bei denen mehrere Intermediäre in die Bildung von RD eingreifen..
Einschränkungen
Das Massenwirkungsgesetz geht davon aus, dass jede chemische Reaktion elementar ist; mit anderen Worten, dass die Molekularität der jeweiligen Reaktionsreihenfolge für jede beteiligte Spezies entspricht.
Hier werden die stöchiometrischen Koeffizienten a, b, c und d als die Anzahl der am Reaktionsmechanismus beteiligten Moleküle betrachtet. In einer globalen Reaktion stimmen diese jedoch nicht unbedingt mit ihrer Reihenfolge überein..
Zum Beispiel für die Reaktion aA + bB <=> cC + dD:
Der Geschwindigkeitsausdruck für die direkten und inversen Reaktionen lautet:
k1= [A]zu[B]b
kzwei= [C]c[D]d
Dies gilt nur für Elementarreaktionen, da für globale Reaktionen zwar die stöchiometrischen Koeffizienten korrekt sind, sie jedoch nicht immer die Reaktionsreihenfolgen sind. Im Falle der direkten Reaktion könnte letztere sein:
k1= [A]w[B]z
In diesem Ausdruck wären w und z die wahren Reaktionsordnungen für die Spezies A und B..
Verweise
- Jeffrey Aronson. (2015, 19. November). Die Gesetze des Lebens: Guldberg und Waages Gesetz der Massenaktion. Abgerufen am 10. Mai 2018 von: cebm.net
- ScienceHQ. (2018). Gesetz der Massenaktion. Abgerufen am 10. Mai 2018 von: sciencehq.com
- Askiitans. (2018). Gesetz der Massenaktion und Gleichgewichtskonstante. Abgerufen am 10. Mai 2018 von: askiitians.com
- Salvat Encyclopedia of Sciences. (1968). Chemie. Band 9, Salvat S.A. von Ausgaben Pamplona, Spanien. P 13-16.
- Walter J. Moore. (1963). Physikalische Chemie. Im Thermodynamik und chemisches Gleichgewicht. (Vierte Ausgabe). Longmans. P 169.
- Alex Yartsev. (2018). Das Gesetz der Massenwirkung in der Pharmakodynamik. Abgerufen am 10. Mai 2018 von: derangedphysiology.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.