
LDH-Funktionen, Bestimmung, Reaktion, Normalwerte
Das Laktatdehydrogenase, Milchsäuredehydrogenase, NAD-abhängige Lactatdehydrogenase oder einfach LDH, ist ein Enzym der Gruppe der Oxidoreduktasen, das in praktisch allen tierischen und pflanzlichen Geweben sowie in vielen Mikroorganismen wie Bakterien, Hefen und Archaeen vorkommt.
Enzyme dieses Typs werden mit der Nummer EC 1.1.1.27 des Enzyme Nomenclature Committee bezeichnet und sind für die Reaktion verantwortlich, die Lactat in Pyruvat umwandelt (durch Oxidation) und umgekehrt (durch Reduktion), wobei Nikotinamidadenindinukleotide (NAD + und oxidiert oder reduziert werden) NADH) in dem als Milchsäuregärung bekannten Verfahren.
Im Gegensatz zur alkoholischen Fermentation, die nur bei einigen Mikroorganismen wie Hefe auftritt und die glykolytisches Pyruvat zur Herstellung von Ethanol verwendet, findet die Milchfermentation in vielen Organismen und Körpergeweben verschiedener Lebewesen statt.
Dieses wichtige Enzym für den Zellstoffwechsel wurde in den 1940er Jahren aus dem Skelettmuskel von Ratten kristallisiert. Bis heute sind Skelettmuskel und Herzgewebe von Säugetieren am besten charakterisiert..
Bei "höheren" Tieren verwendet das Enzym das L-Isomer von Lactat (L-Lactat) zur Herstellung von Pyruvat, aber einige "niedrigere" Tiere und Bakterien produzieren D-Lactat aus Pyruvat, das durch Glykolyse erhalten wird..
Laktatdehydrogenase wird normalerweise hauptsächlich in Geweben oder Zellen unter anaeroben Bedingungen (mit geringer Blutversorgung) exprimiert, die beispielsweise beim Menschen pathologische Zustände wie Krebs, Leber oder Herzerkrankungen charakterisieren können.
Die Umwandlung von Pyruvat in Laktat ist jedoch typisch für die Muskeln während des Trainings und die Hornhaut des Auges, die schlecht mit Sauerstoff angereichert ist.
Artikelverzeichnis
- 1 Funktionen
- 2 Eigenschaften und Struktur
- 3 Bestimmung
- 3.1 Spektrophotometrie
- 3.2 Durch Immunhistochemie
- 3.3 Warum Laktatdehydrogenase bestimmen??
- 4 Reaktion
- 5 Normalwerte
- 6 Was bedeutet es, eine hohe LDH zu haben??
- 7 Referenzen
Eigenschaften
Laktatdehydrogenase erfüllt mehrere Funktionen in zahlreichen Stoffwechselwegen. Es ist das Zentrum des empfindlichen Gleichgewichts zwischen den katabolen und anabolen Kohlenhydratwegen.
Während der aeroben Glykolyse Pyruvat (das letzte Produkt auf dem Weg) an sich) kann als Substrat für den Pyruvat-Dehydrogenase-Enzymkomplex verwendet werden, durch den er decarboxyliert wird, wobei Acetyl-CoA-Moleküle freigesetzt werden, die im Krebszyklus metabolisch gesehen stromabwärts verwendet werden.
Bei der anaeroben Glykolyse hingegen erzeugt der letzte Schritt der Glykolyse Pyruvat, das jedoch von der Laktatdehydrogenase zur Herstellung von Laktat und NAD verwendet wird.+, das stellt den NAD wieder her+ das wurde während der durch Glycerinaldehyd-3-phosphat-Dehydrogenase katalysierten Reaktion verwendet.
Da während der Anaerobiose die Glykolyse die Hauptquelle für die Energieerzeugung in Form von ATP ist, spielt die Laktatdehydrogenase eine grundlegende Rolle bei der Reoxidation von NADH, das in früheren Schritten des glykolytischen Weges erzeugt wurde und für die Funktion anderer verwandter Enzyme wesentlich ist.
Laktatdehydrogenase ist auch an der Glykogenese beteiligt, die in Geweben stattfindet, die Laktat in Glykogen umwandeln, und in einigen aeroben Geweben wie dem Herzen ist Laktat ein Kraftstoff, der reoxidiert wird, um Energie zu erzeugen und Energie in Form von ATP und NAD zu reduzieren+, beziehungsweise.
Eigenschaften und Struktur
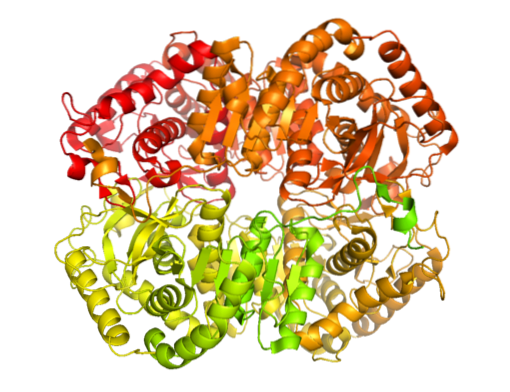
In der Natur gibt es mehrere molekulare Formen der Lactatdehydrogenase. Nur bei Tieren wurde festgestellt, dass es fünf Lactatdehydrogenase-Aktivitäten gibt, die alle tetramer sind und im Wesentlichen aus zwei Arten von Polypeptidketten bestehen, die als H- und M-Untereinheiten bekannt sind (sie können homo- oder heterotetramer sein)..
Die H-Form findet sich typischerweise im Herzgewebe, während die M-Form im Skelettmuskel nachgewiesen wurde. Beide Ketten unterscheiden sich hinsichtlich Häufigkeit, Aminosäurezusammensetzung, kinetischen Eigenschaften und strukturellen Eigenschaften..
Die H- und M-Formen sind das Translationsprodukt verschiedener Gene, die sich möglicherweise auf verschiedenen Chromosomen befinden und auch unter der Kontrolle oder Regulation verschiedener Gene stehen. Die H-Form ist in Geweben mit aerobem Metabolismus und die M-Form in anaeroben Geweben vorherrschend..
Eine andere Art der Nomenklatur verwendet die Buchstaben A, B und C für die verschiedenen Arten von Enzymen sowohl bei Säugetieren als auch bei Vögeln. Daher ist Muskellactatdehydrogenase als A bekannt4, das Herz als B.4 und ein dritter heißt C.4, das ist spezifisch für die Hoden.
Die Expression dieser Isoenzyme wird sowohl entwicklungsabhängig als auch gewebeabhängig reguliert..
Das Enzym wurde aus verschiedenen tierischen Quellen isoliert und es wurde festgestellt, dass seine tetramere Struktur ein durchschnittliches Molekulargewicht von etwa 140 kDa aufweist und dass die Bindungsstelle für NADH oder in NAD+ besteht aus einem β-gefalteten Blatt, das aus sechs Ketten und 4 Alpha-Helices besteht.
Entschlossenheit
Durch Spektrophotometrie
Die Laktatdehydrogenaseaktivität tierischen Ursprungs wird spektrophotometrisch bestimmt in vitro durch Farbänderungsmessungen aufgrund des Redoxprozesses, der während der Umwandlungsreaktion von Pyruvat zu Laktat stattfindet.
Messungen werden bei 340 nm mit einem Spektrophotometer durchgeführt und die Abnahmerate der optischen Dichte aufgrund der Oxidation oder des "Verschwindens" von NADH, das in NAD umgewandelt wird, wird bestimmt.+.
Das heißt, die bestimmte Reaktion ist wie folgt:
Pyruvat + NADH + H.+ → Laktat + NAD+
Die enzymatische Messung muss unter optimalen Bedingungen für den pH-Wert und die Konzentration der Substrate für das Enzym durchgeführt werden, damit kein Risiko besteht, die in den Proben vorhandene Menge aufgrund eines Substratdefizits oder extremer Säure- oder Basizitätsbedingungen zu unterschätzen.
Durch Immunhistochemie
Eine andere, vielleicht etwas modernere Methode zur Bestimmung des Vorhandenseins von Lactatdehydrogenase hat mit der Verwendung immunologischer Instrumente zu tun, dh mit der Verwendung von Antikörpern..
Diese Verfahren nutzen die Affinität zwischen der Bindung eines Antigens an einen spezifisch gegen dieses erzeugten Antikörper und sind sehr nützlich für die schnelle Bestimmung der Anwesenheit oder Abwesenheit von Enzymen wie LDH in einem bestimmten Gewebe..
Je nach Verwendungszweck müssen die verwendeten Antikörper spezifisch für den Nachweis eines der Isoenzyme oder eines Proteins mit Lactatdehydrogenaseaktivität sein..
Warum Laktatdehydrogenase bestimmen?
Die Bestimmung dieses Enzyms erfolgt zu verschiedenen Zwecken, jedoch hauptsächlich zur klinischen Diagnose einiger Erkrankungen, einschließlich Myokardinfarkt und Krebs..
Auf zellulärer Ebene wurde die Freisetzung von Lactatdehydrogenase als einer der Parameter zur Bestimmung des Auftretens nekrotischer oder apoptotischer Prozesse angesehen, da die Plasmamembran durchlässig wird.
Die Produkte der Reaktion, die es katalysiert, können auch in einem Gewebe bestimmt werden, um festzustellen, ob aus einem bestimmten Grund ein anaerober Stoffwechsel vorherrscht..
Reaktion
Wie eingangs erwähnt, ist das Enzym Lactatdehydrogenase, dessen systematischer Name (S.) -Lactat: NAD+ Dehydrogenase katalysiert die Umwandlung von Lactat zu Pyruvat in der NAD-Form+ abhängig oder umgekehrt, was durch die Übertragung eines Hydridions (H.-) von Pyruvat zu Lactat oder von NADH zu oxidiertem Pyruvat.

Der NAD+ Es hat eine ADP-Einheit und eine andere von Nikotinsäure abgeleitete Nukleotidgruppe, auch Niacin oder Vitamin B genannt3, und dieses Coenzym ist an mehreren Reaktionen von großer biologischer Bedeutung beteiligt.
Es ist wichtig zu beachten, dass sich das Gleichgewicht bei dieser Reaktion zur Laktatseite hin verschiebt und gezeigt wurde, dass das Enzym auch andere Säuren oxidieren kann (S.) -2-Hydroxymonocarbonsäuren und setzen, wenn auch weniger effizient, NADP ein+ als Substrat.
In Abhängigkeit von der betrachteten Körperregion und gleichzeitig von ihren metabolischen Eigenschaften in Bezug auf die Anwesenheit oder Abwesenheit von Sauerstoff produzieren Gewebe unterschiedliche Mengen an Laktat, dem Produkt der durch LDH katalysierten Reaktion..
Betrachtet man beispielsweise rote Blutkörperchen (Erythrozyten), denen Mitochondrien fehlen, die Pyruvat, das während der Glykolyse entsteht, zu CO metabolisieren könnenzwei und Wasser, dann könnte man sagen, dass dies die wichtigsten laktatproduzierenden Zellen im menschlichen Körper sind, da alles Pyruvat durch die Wirkung von Laktatdehydrogenase in Laktat umgewandelt wird.
Wenn andererseits Leberzellen und Skelettmuskelzellen berücksichtigt werden, sind sie für die Produktion einer minimalen Menge Laktat verantwortlich, da es schnell metabolisiert wird..
Normalwerte
Die Konzentration der Laktatdehydrogenase im Blutserum ist unter anderem das Produkt der Expression mehrerer Isoenzyme in Leber, Herz, Skelettmuskel, Erythrozyten und Tumoren..
Im Blutserum liegen die normalen Bereiche der Laktatdehydrogenaseaktivität zwischen 260 und 850 U / ml (Einheiten pro Milliliter) mit einem Durchschnittswert von 470 ± 130 U / ml. Inzwischen haben Bluthämolysate eine LDH-Aktivität, die zwischen 16.000 und 67.000 U / ml variiert, was einem Durchschnitt von 34.000 ± 12.000 U / ml entspricht..
Was bedeutet es, eine hohe LDH zu haben??
Die Quantifizierung der Laktatdehydrogenasekonzentration im Blutserum hat einen wichtigen Wert bei der Diagnose einiger Herzerkrankungen, Leber, Blut und sogar Krebs.
Bei Patienten mit Myokardinfarkt (sowohl experimentell als auch klinisch) sowie bei Krebspatientinnen, insbesondere bei Frauen mit Endometrium-, Eierstock-, Brust- und Gebärmutterkrebs, wurde eine hohe LDH-Aktivität festgestellt..
Abhängig von dem speziellen Isozym, das in "Überschuss" oder hoher Konzentration gefunden wird, wird die Quantifizierung von Lactatdehydrogenase-Isoenzymen von vielen behandelnden Ärzten zur Bestimmung von Gewebeschäden (schwer oder chronisch) verwendet..
Verweise
- Bergmeyer, H., Bernt, E. & Hess, B. (1961). Milchsäuredehydrogenase. Methoden der enzymatischen Analyse. Verlag Chemie, GmbH.
- F. Chung, H. Tsujubo, U. Bhattacharyya, F. Sharief & S. Li (1985). Genomische Organisation des humanen Lactatdehydrogenase-A-Gens. Biochemical Journal, 231, 537-541.
- De Becker, D. (2003). Laktatazidose. Intensivpflege MEd, 29, 699-702.
- Everse, J. & Kaplan, N. (1973). Laktatdehydrogenasen: Struktur und Funktion. Im Fortschritte in der Enzymologie und verwandten Bereichen der Molekularbiologie (S. 61-133).
- Fox, S. I. (2006). Humanphysiologie (9. Aufl.). New York, USA: McGraw-Hill Press.
- H. Huijgen, G. T. B. Sanders, R. W. Koster, J. Vreeken & P. M. M. Bossuyt (1997). Der klinische Wert der Laktatdehydrogenase im Serum: Eine quantitative Übersicht. Eur J Clin Chem Clin Biochem, 35(8), 569 & ndash; 579.
- Nomenklaturausschuss der Internationalen Union für Biochemie und Molekularbiologie (NC-IUBMB). (2019). Abgerufen von www.qmul.ac.uk/sbcs/iubmb/enzyme/index.html
- Rawn, J. D. (1998). Biochemie. Burlington, Massachusetts: Neil Patterson Publishers.
- M. Usategui-Gomez, R. W. Wicks & M. Warshaw (1979). Immunchemische Bestimmung des Herzisoenzyms der Lactatdehydrogenase (LDH1) im Humanserum. Clin Chem, 25(5), 729 & ndash; 734.
- Wróblewski, F. & Ladue, J. S. (1955). Laktische Degydrogenase-Aktivität im Blut. Experimentelle Biologie und Medizin, 90, 210-215.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.