
Komplette Eigenschaften, Struktur und Funktionen
Das Integrine Sie sind eine große Gruppe oder Familie von Zelloberflächenproteinen, die anscheinend nur im Tierreich vorkommen. Sie sind die Hauptressource von Zellen, um die Interaktion (in Form von Adhäsion) mit anderen Zellen und mit der Zellmatrix aufrechtzuerhalten.
Seine Struktur besteht aus zwei Untereinheiten, die als Alpha und Beta bezeichnet werden. Bei Säugetieren ist bekannt, dass es zwischen 16 und 18 Alpha-Einheiten und 3 bis 8 Betas gibt, die abhängig von ihrer Kombination und auch vom physiologischen Zustand der Zelle oder des spezifischen Gewebes wirken.
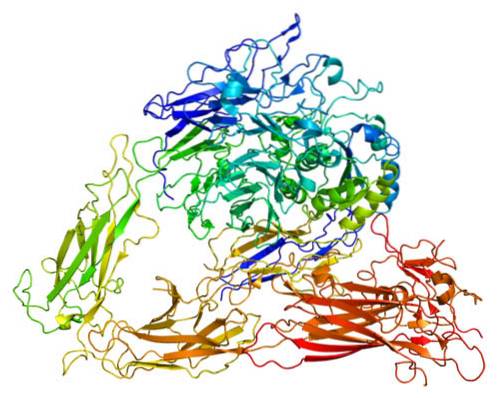
Es gibt mehrere Proteine, die adhäsive Funktionen haben. Die Gruppe der Integrine ist jedoch die am stärksten verteilte und interagiert mit allen Schlüsselproteinen der Zellmatrix. Integrine sind an Phagozytose, Zellmigration und Wundheilung beteiligt und werden sogar in hohem Maße auf ihre Beteiligung an Metastasen untersucht.
Artikelverzeichnis
- 1 Funktionen
- 2 Struktur
- 2.1 Alpha-Untereinheit
- 2.2 Beta-Untereinheit
- 3 Funktionen
- 3.1 Zellanhaftung oder -kopplung an die extrazelluläre Matrix
- 3.2 Signalübertragung von der extrazellulären Matrix zur Zelle
- 4 Integrine und Krebs
- 5 Evolutionsperspektive
- 6 Referenzen
Eigenschaften
Sie sind Proteine, die dadurch gekennzeichnet sind, dass sie das zelluläre Zytoskelett einer Zelle mechanisch mit einer anderen und / oder der extrazellulären Matrix verbinden (in einer Zell-Zell- und / oder Zell-Matrix-Wechselwirkung). Biochemisch erkennen sie, ob eine Adhäsion stattgefunden hat oder nicht, und leiten zelluläre Signale, die die extrazelluläre Umgebung mit der intrazellulären Umgebung verbinden, in beide Richtungen weiter..
Sie arbeiten oder funktionieren mit anderen Rezeptoren wie Immunglobillinen, Cadherin, Selectinen und Syndecanden. Die Liganden der Integrine bestehen unter anderem aus Fibronektin, Fibrinogen, Kollagen und Vitronektin..
Ihre Bindung an ihre Liganden beruht auf extrazellulären zweiwertigen Kationen wie Calcium oder Magnesium. Die Verwendung des einen oder anderen hängt vom spezifischen Integrin ab.
Integrine haben eine längliche Form, die in einem kugelförmigen Kopf endet, der nach elektronenmikroskopischen Beobachtungen mehr als 20 Nanometer von der Lipiddoppelschicht absteht.
Struktur
Quelle: Biowissenschaftliche Bildbibliothek des Berkshire Community College [CC0]
Integrine sind Heterodimere, dh sie sind Moleküle, die immer aus zwei Proteinen bestehen. Beide Proteine werden als Untereinheiten oder Protomere betrachtet und als Alpha-Untereinheiten und Beta-Untereinheiten unterschieden. Beide Untereinheiten sind nicht kovalent verknüpft. Sie haben eine Molmasse zwischen 90 und 160 kDa.
Die Anzahl der Alpha- und Beta-Untereinheiten variiert zwischen verschiedenen Gruppen von Organismen im Tierreich. Bei Insekten wie der Fruchtfliege (Drosophyla) gibt es zum Beispiel 5 Alpha- und 2 Beta-Untereinheiten, während in Nematodenwürmern der Gattung Caenorhabditis Es gibt 2 Alphas und eine Beta.
Bei Säugetieren schlagen die Forscher vor, dass es eine feste Anzahl von Untereinheiten und deren Kombinationen gibt; In der Literatur besteht jedoch kein Konsens über diese Zahl. Einige erwähnen beispielsweise, dass es 18 Alpha-Untereinheiten, 8 Beta-Kombinationen und 24 Kombinationen gibt, während andere von 16 Alpha-Versionen und 8 Beta-Kombinationen für 22 Kombinationen sprechen.
Jede Untereinheit hat die folgende Struktur.
Alpha-Untereinheit
Die Alpha-Untereinheit hat eine Struktur mit einer β-Helix-Domäne von sieben Blättern oder Blättern, die den Kopf bilden, einer Domäne im Oberschenkel, zwei Domänen des Kalbes, einer einzelnen Transmembrandomäne und auch einem kurzen zytoplasmatischen Schwanz, der keine enzymatische Aktivität aufweist oder Aktinbindung.
Es präsentiert Ketten mit etwa 1000 bis 1200 Resten. Kann zweiwertige Kationen binden.
Bei Säugetieren, bei denen die Integrine am meisten untersucht wurden, können die Alpha-Untereinheiten danach gruppiert werden, ob sie eine inserierte Domäne (Alpha I) enthalten oder nicht..
Mit eingefügter Domain Alpha I.
Die inserierte Alpha I-Domäne besteht aus einer Region mit 200 Aminosäuren. Das Vorhandensein dieser Domäne in den Integrinen zeigt an, dass sie Rezeptoren für Kollagen und Leukozyten sind..
Keine Domain eingefügt
Die Alpha-Integrine, die nicht über die integrierte Domäne verfügen, werden in 4 Unterfamilien eingeteilt, die wir unten sehen werden.
PS1
Glykoproteinrezeptoren, auch Laminine genannt, sind für die Integration von Muskel-, Nieren- und Hautgewebe von entscheidender Bedeutung.
PS2
Diese Unterfamilie ist der Rezeptor für Arginylglycylasparaginsäure, auch bekannt als RGD oder Arg-Gly-Asp..
PS3
Diese Unterfamilie wurde bei Wirbellosen, insbesondere Insekten, beobachtet. Obwohl wenig darüber bekannt ist, gibt es Studien, die seine wesentliche Rolle bei der funktionellen Aktivität des CD11d-Leukozyten-Integrin-Gens beim Menschen bewerten..
PS4
Diese Unterfamilie ist als Alpha 4 / Alpha 9-Gruppe bekannt und umfasst die Untereinheiten mit denselben Namen..
Diese Untereinheiten können sich mit den Beta 1- und Beta 7-Untereinheiten paaren. Sie teilen auch Liganden, die den Alpha-Untereinheiten, die die inserierte Alpha I-Domäne aufweisen, sehr ähnlich sind, wie Gefäßzelladhäsionsmoleküle, blutlösliche Liganden, Fibrinogen und andere, einschließlich sogar Krankheitserreger.
Beta-Untereinheit
Strukturell besteht die Beta-Untereinheit aus einem Kopf, einem Abschnitt, der als Stamm / Bein bezeichnet wird, einer Transmembrandomäne und einem zytoplasmatischen Schwanz. Der Kopf besteht aus einer Beta I-Domäne, die sich in eine Hybriddomäne einfügt, die an die Plexin-Semaphor-Integrin-Domäne, auch als PSI bekannt, bindet..
Der Stamm- / Beinabschnitt enthält vier Module, die dem epidermalen Wachstumsfaktor des Cystein-reichen Integrins gleich oder sehr ähnlich sind, und, wie bereits erwähnt, einen zytoplasmatischen Schwanz. Dieser cytoplasmatische Schwanz hat wie in der Alpha-Untereinheit keine enzymatische oder aktinbindende Aktivität..
Sie haben Ketten mit einer Anzahl von Resten zwischen 760 und 790 und können wie die Alpha-Untereinheiten zweiwertige Kationen binden.
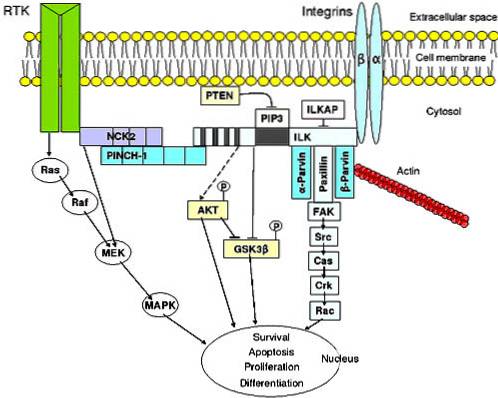
Eigenschaften
Integrine haben mehrere Funktionen, für die sie jedoch hauptsächlich bekannt sind, sind diejenigen, die wir unten sehen werden.
Anheftung oder Kopplung der Zelle an die extrazelluläre Matrix
Die Verbindung, die dank der Integrine zwischen der Zelle und der extrazellulären Matrix besteht, begünstigt die Beständigkeit der Zelle gegen mechanischen Druck und verhindert, dass sie aus der Matrix herausgerissen werden.
Mehrere Studien legen nahe, dass die Kopplung an die Zellmatrix eine Grundvoraussetzung für die Entwicklung mehrzelliger eukaryotischer Organismen ist..
Zellmigration ist ein Prozess, bei dem Integrine durch Bindung oder Kopplung an verschiedene Substrate eingreifen. Dank dieser greifen sie in die Immunantwort und die Wundheilung ein.
Signalübertragung von der extrazellulären Matrix zur Zelle
Integrine sind am Signalübertragungsprozess beteiligt. Dies bedeutet, dass sie in den Empfang von Informationen aus der extrazellulären Flüssigkeit eingreifen, diese codieren und dann als Reaktion die Veränderung der intrazellulären Moleküle beginnt.
Diese Signalübertragung ist an einer Vielzahl von physiologischen Prozessen beteiligt, wie z. B. programmierter Zellzerstörung, Zelldifferenzierung, Meiose und Mitose (Zellteilung) und Zellwachstum..
Integrine und Krebs
Mehrere Studien zeigen, dass Integrine eine wichtige Rolle bei der Tumorentwicklung spielen, insbesondere bei der Metastasierung und Angiogenese. Ein Beispiel hierfür sind unter anderem die Integrine αVβ3 und α1β1..
Diese Integrine wurden mit Krebswachstum, erhöhter therapeutischer Resistenz und hämatopoetischen Neoplasmen in Verbindung gebracht.
Evolutionsperspektive
Eine effiziente Adhäsion zwischen Zellen zur Bildung von Geweben war ohne Zweifel ein entscheidendes Merkmal, das bei der evolutionären Entwicklung mehrzelliger Organismen vorhanden gewesen sein muss..
Die Entstehung der Integrinfamilie wurde auf das Auftreten der Metazoen vor etwa 600 Millionen Jahren zurückgeführt..
Eine Gruppe von Tieren mit histologischen Merkmalen der Vorfahren sind die porösen, üblicherweise als Seeschwämme bezeichneten Tiere. Bei diesen Tieren erfolgt die Zelladhäsion durch eine extrazelluläre Proteoglycanmatrix. Rezeptoren, die an diese Matrix binden, besitzen ein typisches Integrin-Bindungsmotiv.
Tatsächlich wurden in dieser Tiergruppe Gene identifiziert, die mit bestimmten Untereinheiten einiger Integrine verwandt sind..
Im Laufe der Evolution erwarb der Vorfahr der Metazoen ein Integrin und eine Bindungsdomäne dafür, die im Laufe der Zeit in dieser immensen Tiergruppe konserviert wurden..
Strukturell sehen wir die maximale Komplexität der Integrine in der Gruppe der Wirbeltiere. Es gibt verschiedene Integrine, die bei Wirbellosen nicht vorhanden sind, mit neuen Domänen. Tatsächlich wurden beim Menschen mehr als 24 verschiedene funktionelle Integrine identifiziert - bei Fruchtfliegen Drosophila melanogaster es gibt nur 5.
Verweise
- Integrin. Klinik der Universität von Navarra. Von cun.es wiederhergestellt.
- Beitritt. Atlas der Pflanzen- und Tierhistologie. Von mmegias.webs.uvigo.es wiederhergestellt.
- B. Alberts, A. Johnson, J. Lewis et al. (2002). Molekularbiologie der Zelle. 4. Auflage. New York: Garland Science. Integrine. Von ncbi.nlm.nih.gov wiederhergestellt.
- R.L. Anderson, T.W. Owens & J. Matthew (2014). Strukturelle und mechanische Funktionen von Integrinen. Biophysikalische Übersichten.
- Integrität. Von en.wikipedia.org wiederhergestellt.
- Was ist Integrin? MBINFO. Von mechanobio.info wiederhergestellt.
- S. Mac Fhearraigh & D. Bruce. Die Rolle von Integrinen bei der Signalübertragung von Zellen. Von abcam.com wiederhergestellt.
- .


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.