
Bedeutung chemischer Elemente für Lebewesen

Das Chemische Elemente haben für Lebewesen eine große Bedeutung, denn ohne sie wäre ein Leben nicht möglich. Es ist eine anerkannte Tatsache in der wissenschaftlichen Gemeinschaft, dass ohne Wasser kein Leben möglich wäre. Andererseits basiert das auf der Erde bekannte organische Leben auf Kohlenstoff.
Heute werden etwa 115 chemische Elemente erkannt, die in Metalle, Übergangsmetalle, Nichtmetalle und Edelgase unterteilt sind.
Die chemischen Elemente sind wiederum in 18 Gruppen unterteilt:
- Metalle: Alkalimetalle (Gruppe 1) und Erdalkalimetalle (Gruppe 2).
- Übergangsmetalle: Scandiumfamilie (Gruppe 3), Titanfamilie (Gruppe 4), Vanadiumfamilie (Gruppe 5), Chromfamilie (Gruppe 6), Manganfamilie (Gruppe 7), Eisenfamilie (Gruppe 8), Kobaltfamilie (Gruppe 9) ), Nickelfamilie (Gruppe 10), Kupferfamilie (Gruppe 11) und Zinkfamilie (Gruppe 12).
- Nichtmetalle: Erden (Gruppe 13), Carbonide (Gruppe 14), Stickstoffide (Gruppe 15), Calgogene (Gruppe 16) und Halogene (Gruppe 17).
- Edelgase (Gruppe 18).
Zwei oder mehr Elemente können kombiniert werden, um komplexere Verbindungen herzustellen. Tatsächlich besteht die gesamte vorhandene Materie aus chemischen Elementen, selbst Lebewesen (Pflanzen, Tiere und Menschen) sind Konglomerate von Milliarden von Atomen. Daher seine Bedeutung.
Chemische Elemente und Lebewesen
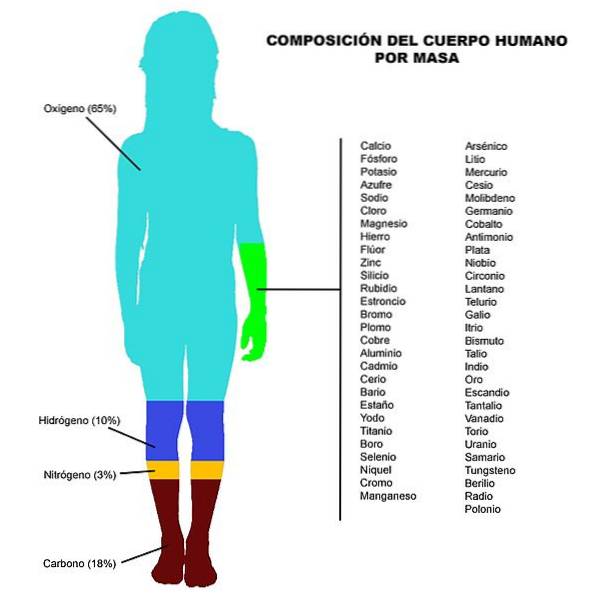
Wie bereits erwähnt, bestehen Lebewesen aus mehreren chemischen Elementen. Es ist zu beachten, dass in lebenden Organismen am häufigsten Kohlenstoff, Wasserstoff, Sauerstoff und Stickstoff vorkommen, die 90% der lebenden Materie ausmachen.
Diese vier Elemente sind die Bestandteile bestimmter biologischer (oder organischer) Moleküle wie Kohlenhydrate, Proteine, Lipide und Nukleinsäuren (wie Ribonukleinsäure-RNA- und Desoxyribonukleinsäure -DNA-). Andere Elemente wie Phosphor, Schwefel, Kalzium und Kalium sind in geringerer Menge vorhanden.
Kohlenstoff und Lebewesen
Kohlenstoff ist das vierthäufigste Element im Universum und die wesentliche Grundlage des Lebens auf dem Planeten Erde..
Wie im vorherigen Abschnitt erläutert, bestehen alle Lebewesen aus Kohlenstoff. Dieses Element hat eine molekulare Struktur, die es ihm ermöglicht, verschiedene Bindungen mit mehreren Elementen herzustellen, was von Vorteil ist.
Kohlenstoff zirkuliert durch Land, Ozean und Atmosphäre und erzeugt den sogenannten Kohlenstoffkreislauf..
Der Kohlenstoffkreislauf
Der Kohlenstoffkreislauf bezieht sich auf den Recyclingprozess dieses Elements. Tiere verbrauchen Glukose (C6H1206) während des Lebensmittelstoffwechsels und der Atmung.
Dieses Molekül verbindet sich mit Sauerstoff (02) und erzeugt so Kohlendioxid (CO2), Wasser (H02) und Energie, die in Form von Wärme freigesetzt werden.
Tiere brauchen kein Kohlendioxid, also geben sie es an die Atmosphäre ab. Andererseits können Pflanzen dieses Gas durch einen Prozess nutzen, der als „Photosynthese“ bezeichnet wird. Dieser Prozess erfordert das Vorhandensein von drei Elementen:
- Kohlendioxid, das durch Stomata in ihren Blättern in Pflanzen gelangt.
- Das Wasser, das dank der Wurzeln der Pflanzen aufgenommen wird.
- Sonnenenergie, die von Chlorophyll eingefangen wird.
CO2, das Wassermolekülen und Energie aus dem Sonnenlicht zugesetzt wird, ermöglicht Pflanzen:
- Geben Sie während der Lichtphase der Photosynthese Sauerstoff frei.
- Synthetisieren Sie Kohlenhydrate wie Glucose während der Dunkelphase der Photosynthese.
Chemische Reaktion der Photosynthese
- COzwei + H.zweiODER + Licht und Chlorophyll → CHzweiO + O.zwei
- Kohlendioxid + Wasser + Licht → Kohlenhydrate + Sauerstoff
Tiere nehmen Sauerstoff auf und verbrauchen Glukose aus Pflanzen, wodurch der Zyklus von vorne beginnt..
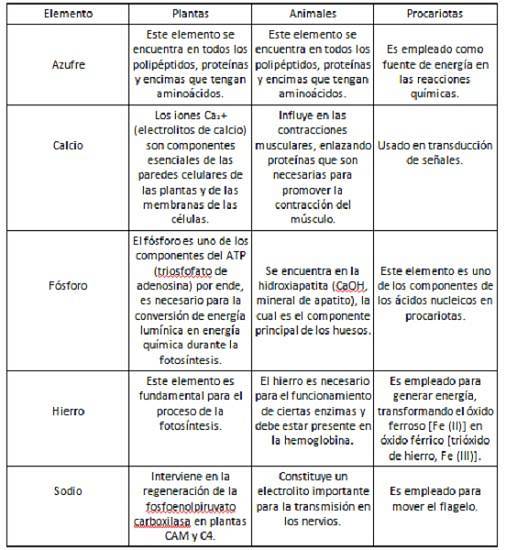
Einfluss anderer Elemente auf Pflanzen, Tiere und Prokaryoten
In der folgenden Tabelle sind einige der Rollen aufgeführt, die Schwefel, Kalzium, Phosphor, Eisen und Natrium in Pflanzen, Tieren und Prokaryoten spielen..
Verweise
- Das Periodensystem: Atome, Elemente und Isotope - Genesis Mission. Abgerufen am 4. Mai 2017 von Genesismission.jpl.nasa.gov.
- Die Geschichte und Verwendung der chemischen Elemente unserer Erde. Abgerufen am 4. Mai 2017 von univpgri-palembang.ac.id.
- Einführung in Chemie, Atome und Elemente. Abgerufen am 4. Mai 2017 von utc.edu.
- Materie: Elemente und Verbindungen. Abgerufen am 4. Mai 2017 von home.ku.edu.tr.
- Chemische Elemente. Abgerufen am 4. Mai 2017 von minsocam.org.
- 100 wichtigsten chemischen Verbindungen: Ein Referenzhandbuch Abgerufen am 4. Mai 2017 von bitdownload.ir.
- Chemieunterricht durch Geschichte: Die Bedeutung der Zeitschrift. Abgerufen am 4. Mai 2017 von euchems.eu.
- Chemische Elemente. Abgerufen am 4. Mai 2017 von ibbiologyhelp.com.

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.