
Lithiumhydridstruktur, Eigenschaften, Herstellung, Verwendung

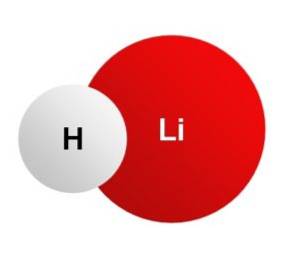
Das Lithiumhydrid Es ist ein kristalliner anorganischer Feststoff, dessen chemische Formel LiH lautet. Es ist das leichteste anorganische Salz, sein Molekulargewicht beträgt nur 8 g / mol. Es entsteht durch die Vereinigung eines Lithiumions Li+ und ein Hydridion H.-. Beide sind durch eine Ionenbindung verbunden.
LiH hat einen hohen Schmelzpunkt. Es reagiert leicht mit Wasser und bei der Reaktion entsteht Wasserstoffgas. Es kann durch die Reaktion zwischen geschmolzenem Lithiummetall und Wasserstoffgas erhalten werden. Es wird häufig in chemischen Reaktionen verwendet, um andere Hydride zu erhalten.
LiH wurde zum Schutz vor gefährlicher Strahlung verwendet, wie sie in Kernreaktoren wie ALPHA-, BETA-, GAMMA-Strahlung, Protonen, Röntgenstrahlen und Neutronen zu finden ist..
Es wurde auch zum Schutz von Materialien in Weltraumraketen vorgeschlagen, die durch nuklearen thermischen Antrieb angetrieben werden. Es werden sogar Studien durchgeführt, um den Menschen bei zukünftigen Reisen zum Planeten Mars vor kosmischer Strahlung zu schützen..
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Siedepunkt
- 3.5 Selbstentzündungstemperatur
- 3.6 Dichte
- 3.7 Löslichkeit
- 3.8 Andere Eigenschaften
- 4 Erhalten
- 5 Als Schutzschild gegen gefährliche Strahlung verwenden
- 5.1 - In Kernreaktoren
- 5.2 - In Weltraumsystemen des nuklearen thermischen Antriebs
- 5.3 - Zum Schutz vor kosmischer Strahlung
- 6 Verwendung als sicheres Lager und Transportmittel für Wasserstoff
- 7 Verwendung bei chemischen Reaktionen
- 8 Referenzen
Struktur
Wasserstoff in Lithiumhydrid hat eine negative Ladung H.-, da es ein Elektron vom Metall subtrahiert hat, das in Form eines Li-Ions vorliegt+.
Die Elektronenkonfiguration des Li-Kations+ ist: [He] 1szwei das ist sehr stabil. Und die elektronische Struktur des Hydridanions H.- ist: 1szwei, das ist auch sehr stabil.
Das Kation und das Anion sind durch elektrostatische Kräfte verbunden.
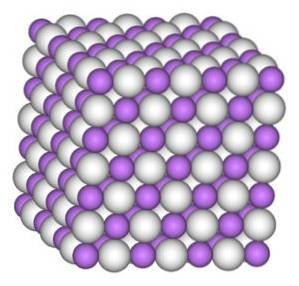
Der Lithiumhydridkristall hat die gleiche Struktur wie Natriumchlorid NaCl, dh eine kubische Kristallstruktur.
Nomenklatur
- Lithiumhydrid
- LiH
Eigenschaften
Körperlicher Status
Weißer oder farbloser kristalliner Feststoff. Kommerzielles LiH kann aufgrund der Anwesenheit kleiner Mengen Lithiummetall blaugrau sein..
Molekulargewicht
8 g / mol
Schmelzpunkt
688 ºC
Siedepunkt
Es zersetzt sich bei 850 ºC.
Selbstentzündungstemperatur
200 ºC
Dichte
0,78 g / cm3
Löslichkeit
Reagiert mit Wasser. Es ist in Ethern und Kohlenwasserstoffen unlöslich.
Andere Eigenschaften
Lithiumhydrid ist viel stabiler als Hydride der anderen Alkalimetalle und kann ohne Zersetzung geschmolzen werden..
Es wird nicht durch Sauerstoff beeinflusst, wenn es auf Temperaturen unter Rot erhitzt wird. Es wird auch nicht von Chlor Cl beeinflusstzwei und Salzsäure HCl.
Der Kontakt von LiH mit Wärme und Feuchtigkeit verursacht eine exotherme Reaktion (erzeugt Wärme) und die Entwicklung von Wasserstoff H.zwei und Lithiumhydroxid LiOH.
Es kann sich ein feiner Staub bilden, der bei Kontakt mit Flammen, Hitze oder oxidierenden Materialien explodieren kann. Es darf nicht mit Lachgas oder flüssigem Sauerstoff in Kontakt kommen, da es explodieren oder sich entzünden kann.
Es wird dunkler, wenn es Licht ausgesetzt wird.
Erhalten
Lithiumhydrid wurde im Labor durch die Reaktion zwischen geschmolzenem Lithiummetall und Wasserstoffgas bei einer Temperatur von 973 K (700 ºC) erhalten..
2 Li + H.zwei → 2 LiH
Gute Ergebnisse werden erhalten, wenn die freiliegende Oberfläche des geschmolzenen Lithiums vergrößert wird und wenn die Sedimentationszeit des LiH verringert wird. Es ist eine exotherme Reaktion.
Verwendung als Schutzschild gegen gefährliche Strahlung
LiH weist eine Reihe von Eigenschaften auf, die es für den Einsatz als Schutz für Menschen in Kernreaktoren und Raumfahrtsystemen attraktiv machen. Hier sind einige dieser Eigenschaften:
- Es hat einen hohen Wasserstoffgehalt (12,68 Gew .-% H) und eine hohe Anzahl von Wasserstoffatomen pro Volumeneinheit (5,85 x 10)22 H Atome / cm3).
- Sein hoher Schmelzpunkt ermöglicht den Einsatz in Hochtemperaturumgebungen ohne Schmelzen.
- Es hat einen niedrigen Dissoziationsdruck (~ 20 Torr an seinem Schmelzpunkt), wodurch das Material geschmolzen und gefroren werden kann, ohne sich unter niedrigem Wasserstoffdruck zu verschlechtern..
- Es hat eine geringe Dichte, was es für den Einsatz in Raumfahrtsystemen attraktiv macht..
- Seine Nachteile sind jedoch die geringe Wärmeleitfähigkeit und die schlechten mechanischen Eigenschaften. Dies hat jedoch seine Anwendbarkeit nicht beeinträchtigt.
- Die LiH-Teile, die als Schutzschilde dienen, werden durch Heiß- oder Kaltpressen sowie durch Schmelzen und Gießen in Formen hergestellt. Obwohl diese letzte Form bevorzugt wird.
- Bei Raumtemperatur werden die Teile durch einen geringen Überdruck von Wasserstoff in einem verschlossenen Behälter vor Wasser und Wasserdampf sowie bei hohen Temperaturen geschützt.
- In Kernreaktoren
In Kernreaktoren gibt es zwei Arten von Strahlung:
Direkt ionisierende Strahlung
Es handelt sich um hochenergetische Teilchen, die elektrische Ladung tragen, wie Alpha (α) - und Beta (β) -Partikel und Protonen. Diese Art von Strahlung interagiert sehr stark mit den Materialien der Abschirmungen und verursacht eine Ionisierung, indem sie mit den Elektronen der Atome der Materialien interagiert, durch die sie hindurchtreten..
Indirekt ionisierende Strahlung
Es handelt sich um Neutronen, Gammastrahlen (γ) und Röntgenstrahlen, die eindringen und einen massiven Schutz erfordern, da sie die Emission von sekundär geladenen Teilchen beinhalten, die die Ionisation verursachen..

Laut einigen Quellen schützt LiH Materialien und Menschen wirksam vor diesen Arten von Strahlung.
- In Weltraumsystemen des nuklearen thermischen Antriebs
LiH wurde kürzlich als potenzieller Moderator und Schutzmaterial gegen nukleare Strahlung für nukleare thermische Antriebssysteme von Raumfahrzeugen mit sehr langer Reise ausgewählt..

Seine geringe Dichte und sein hoher Wasserstoffgehalt ermöglichen es, die Masse und das Volumen des kernbetriebenen Reaktors effektiv zu reduzieren..
- Zum Schutz vor kosmischer Strahlung
Die Exposition gegenüber Weltraumstrahlung ist das wichtigste Risiko für die menschliche Gesundheit bei zukünftigen interplanetaren Erkundungsmissionen.
Im Weltraum werden Astronauten dem gesamten Spektrum galaktischer kosmischer Strahlen (hochenergetische Ionen) und Ejektionsereignissen von Sonnenpartikeln (Protonen) ausgesetzt..
Die Gefahr der Strahlenexposition wird durch die Länge der Missionen erhöht. Darüber hinaus muss auch der Schutz der Orte berücksichtigt werden, an denen Entdecker leben werden.

In diesem Sinne ergab eine 2018 durchgeführte Studie, dass LiH unter den getesteten Materialien die größte Verringerung der Strahlung pro Gramm pro cm bewirktzwei, Damit ist er einer der besten Kandidaten für den Schutz vor kosmischer Strahlung. Diese Studien müssen jedoch vertieft werden.
Verwendung als sicheres Speicher- und Transportmedium für Wasserstoff
Energiegewinnung aus H.zwei Es ist etwas, das seit mehreren Dutzend Jahren untersucht wurde und bereits Anwendung gefunden hat, um fossile Brennstoffe in Transportfahrzeugen zu ersetzen.
Die H.zwei kann in Brennstoffzellen eingesetzt werden und zur Reduzierung der CO-Produktion beitragenzwei und neinx, So werden Treibhauseffekte und Umweltverschmutzung vermieden. Ein wirksames System zum Speichern und Transportieren von H wurde jedoch noch nicht gefundenzwei sicher, leicht, kompakt oder klein, schnell zu lagern und freizugebenzwei gleich schnell.
Lithiumhydrid LiH ist eines der Alkalihydride mit der höchsten Speicherkapazität für H.zwei (12,7 Gew .-% H). Lassen Sie H loszwei durch Hydrolyse gemäß der folgenden Reaktion:
LiH + H.zweiO → LiOH + H.zwei
LiH liefert 0,254 kg Wasserstoff pro kg LiH. Darüber hinaus hat es eine hohe Speicherkapazität pro Volumeneinheit, was bedeutet, dass es leicht und ein kompaktes Medium für die Speicherung von H istzwei.

Darüber hinaus bildet sich LiH leichter als andere Alkalimetallhydride und ist bei Umgebungstemperaturen und -drücken chemisch stabil. Das LiH kann vom Hersteller oder Lieferanten zum Benutzer transportiert werden. Dann wird durch Hydrolyse von LiH H erzeugtzwei und dies wird sicher verwendet.
Das gebildete Lithiumhydroxid LiOH kann an den Lieferanten zurückgegeben werden, der das Lithium durch Elektrolyse regeneriert und dann wieder LiH erzeugt..
Es wurde auch erfolgreich untersucht, ob LiH in Verbindung mit boriertem Hydrazin für den gleichen Zweck verwendet werden kann..
Verwendung bei chemischen Reaktionen
LiH ermöglicht die Synthese komplexer Hydride.
Es wird zum Beispiel verwendet, um Lithiumtriethylborhydrid herzustellen, das ein starkes Nucleophil in organischen Halogenidverdrängungsreaktionen ist..
Verweise
- Sato, Y. und Takeda, O. (2013). Wasserstoffspeicher- und -transportsystem durch Lithiumhydrid unter Verwendung der Salzschmelztechnologie. In der Chemie geschmolzener Salze. Kapitel 22, Seiten 451-470. Von sciencedirect.com wiederhergestellt.
- UNS. Nationalbibliothek für Medizin. (2019). Lithiumhydrid. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov.
- Wang, L. et al. (2019). Untersuchung des Einflusses des thermischen Kerneffekts von Lithiumhydrid auf die Reaktivität des Partikelbettreaktors mit Kernantrieb. Annals of Nuclear Energy 128 (2019) 24-32. Von sciencedirect.com wiederhergestellt.
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.
- M. Giraudo et al. (2018). Beschleunigerbasierte Tests der Abschirmwirksamkeit verschiedener Materialien und Mehrfachschichten unter Verwendung von hochenergetischen leichten und schweren Ionen. Strahlenforschung 190; 526-537 (2018). Von ncbi.nlm.nih.gov wiederhergestellt.
- Welch, F.H. (1974). Lithiumhydrid: Ein Abschirmmaterial für das Weltraumzeitalter. Nuclear Engineering and Design 26, 3. Februar 1974, Seiten 444-460. Von sciencedirect.com wiederhergestellt.
- Simnad, M. T. (2001). Kernreaktoren: Abschirmmaterialien. In der Encyclopedia of Materials: Science and Technology (Zweite Ausgabe). Seiten 6377-6384. Von sciencedirect.com wiederhergestellt.
- Hügle, T. et al. (2009). Hydrazin Boran: Ein vielversprechendes Wasserstoffspeichermaterial. J. Am. Chem. Soc. 2009, 131, 7444 & ndash; 7446. Von pubs.acs.org wiederhergestellt.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.