
Chemische Hybridisierung sp, sp2, sp3
Das chemische Hybridisierung Es ist die "Mischung" von Atomorbitalen, deren Konzept 1931 vom Chemiker Linus Pauling eingeführt wurde, um die Unvollkommenheiten der Valencia-Bindungstheorie (TEV) abzudecken. Welche Unvollkommenheiten? Dies sind: Molekülgeometrien und äquivalente Bindungslängen in Molekülen wie Methan (CH4).
Laut TEV bilden die C-Atomorbitale in Methan vier σ-Bindungen mit vier H-Atomen. Die 2p-Orbitale mit Formformen (unteres Bild) von C stehen senkrecht zueinander, so dass das H bei a etwa einige von anderen sein sollte 90º Winkel.
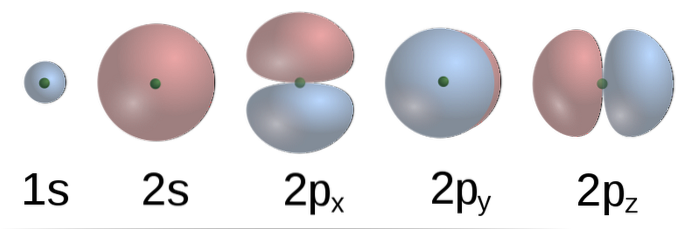
Zusätzlich bindet das 2s (sphärische) Orbital von C unter einem Winkel von 135º in Bezug auf die anderen drei H an das 1s-Orbital von H. Experimentell wurde jedoch gefunden, dass die Winkel in CH4 sind 109,5º und dass zusätzlich die Längen der C-H-Bindungen äquivalent sind.
Um dies zu erklären, muss eine Kombination der ursprünglichen Atomorbitale betrachtet werden, um vier entartete Hybridorbitale (gleicher Energie) zu bilden. Hier kommt die chemische Hybridisierung ins Spiel. Wie sind Hybridorbitale? Es hängt von den Atomorbitalen ab, die sie erzeugen. Sie weisen auch eine Mischung der elektronischen Eigenschaften dieser auf.
Artikelverzeichnis
- 1 sp3-Hybridisierung
- 1.1 Interpretation
- 1.2 Abweichungen der Bindungswinkel
- 2 sp2-Hybridisierung
- 3 sp Hybridisierung
- 4 Referenzen
Sp-Hybridisierung3
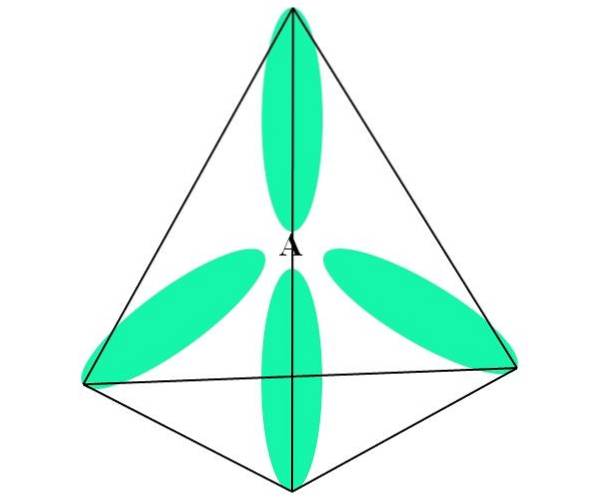
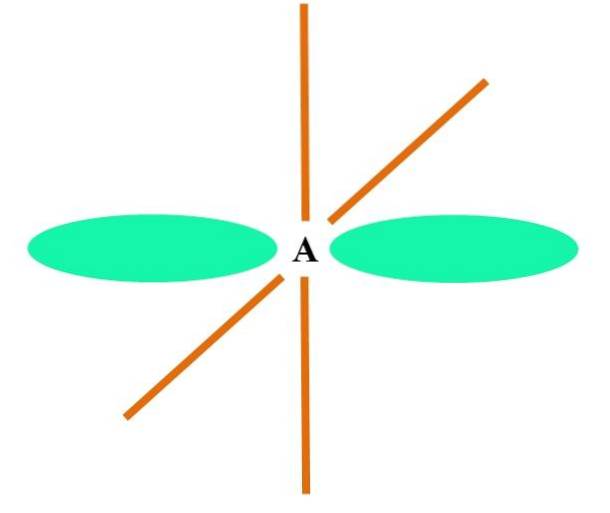
Im Fall von CH4, Die Hybridisierung von C ist sp3. Aus diesem Ansatz wird die Molekülgeometrie mit vier sp-Orbitalen erklärt3 109,5º voneinander entfernt und in Richtung der Eckpunkte eines Tetraeders zeigend.
Im oberen Bild sehen Sie, wie die sp-Orbitale3 (grün gefärbt) stellen eine tetraedrische elektronische Umgebung um das Atom her (A, das C für CH ist4).
Warum 109,5º und nicht andere Winkel, um eine andere Geometrie zu "zeichnen"? Der Grund ist, dass dieser Winkel die elektronischen Abstoßungen der vier Atome, die an A binden, minimiert.
Somit ist das CH-Molekül4 kann als Tetraeder dargestellt werden (tetraedrische Molekülgeometrie).
Wenn C anstelle von H Bindungen mit anderen Atomgruppen eingehen würde, was wäre dann ihre Hybridisierung? Solange der Kohlenstoff vier σ (C-A) -Bindungen bildet, ist ihre Hybridisierung sp3.
Es kann folglich angenommen werden, dass in anderen organischen Verbindungen wie CH3OH, CCl4, C (CH3)4, C.6H.12 (Cyclohexan) usw. hat der Kohlenstoff eine sp-Hybridisierung3.
Dies ist wichtig für die Skizze organischer Strukturen, bei denen einfach gebundene Kohlenstoffe Divergenzpunkte darstellen. Das heißt, die Struktur bleibt nicht in einer einzigen Ebene.
Interpretation
Was ist die einfachste Interpretation für diese Hybridorbitale, ohne die mathematischen Aspekte (die Wellenfunktionen) zu berücksichtigen? Die sp-Orbitale3 implizieren, dass sie von vier Orbitalen stammen: eins s und drei p.
Da die Kombination dieser Atomorbitale als ideal angenommen wird, sind die vier sp-Orbitale3 Die resultierenden sind identisch und nehmen unterschiedliche Orientierungen im Raum ein (wie in den p-Orbitalenx, pY. Und Pz).
Das Obige gilt für den Rest der möglichen Hybridisierungen: Die Anzahl der gebildeten Hybridorbitale ist dieselbe wie die der kombinierten Atomorbitale. Zum Beispiel sp-Hybridorbitale3dzwei werden aus sechs Atomorbitalen gebildet: eins s, drei p und zwei d.
Bindungswinkelabweichungen
Nach der Valencia Shell Electronic Pair Repulsion Theory (RPECV) nimmt ein Paar freier Elektronen mehr Volumen ein als ein gebundenes Atom. Dies führt dazu, dass sich die Glieder auseinander bewegen, die elektronische Spannung verringern und die Winkel von 109,5 ° abweichen:
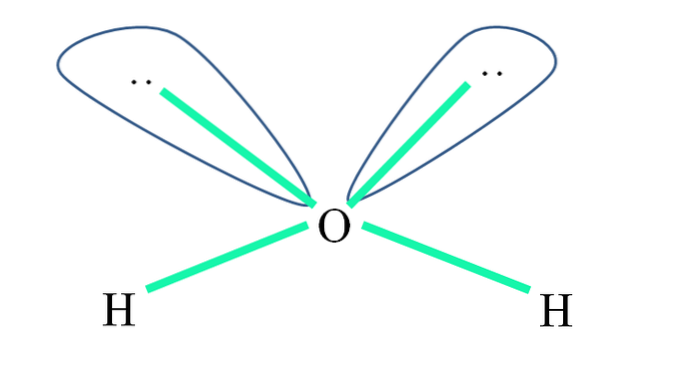
Beispielsweise sind im Wassermolekül die H-Atome an die sp-Orbitale gebunden3 (in grün) und ebenso die ungeteilten Elektronenpaare ":" besetzen diese Orbitale.
Die Abstoßungen dieser Elektronenpaare werden üblicherweise als "zwei Globen mit Augen" dargestellt, die aufgrund ihres Volumens die beiden σ O-H-Bindungen abstoßen.
In Wasser betragen die Bindungswinkel also tatsächlich 105º anstelle der für die tetraedrische Geometrie erwarteten 109,5º..
Welche Geometrie macht dann der H.zweiODER? Es hat eine Winkelgeometrie. Warum? Denn obwohl die elektronische Geometrie tetraedrisch ist, verzerren zwei Paare ungeteilter Elektronen sie zu einer eckigen Molekülgeometrie.
Sp-Hybridisierungzwei
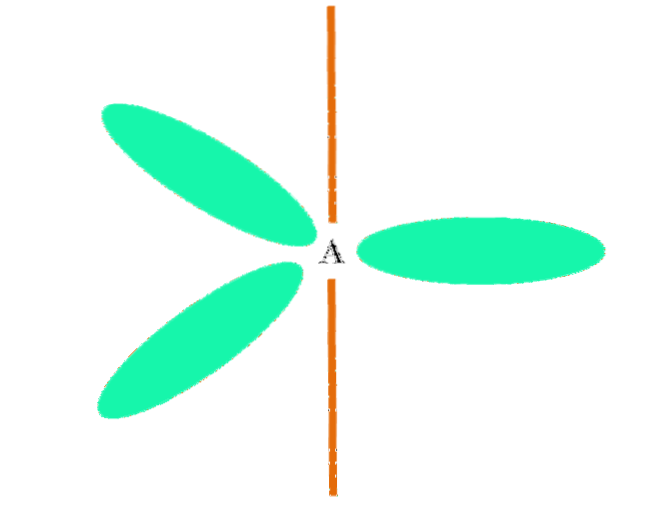
Wenn ein Atom zwei p- und ein s-Orbitale kombiniert, erzeugt es drei hybride sp-Orbitalezwei;; Ein p-Orbital bleibt jedoch unverändert (da es drei davon gibt), was im oberen Bild als orangefarbener Balken dargestellt wird.
Hier die drei sp-Orbitalezwei Sie sind grün gefärbt, um ihren Unterschied zum orangefarbenen Balken hervorzuheben: das "reine" p-Orbital.
Ein Atom mit sp-Hybridisierungzwei kann als flacher trigonaler Boden dargestellt werden (das mit den sp-Orbitalen gezeichnete Dreieckzwei grün), dessen Eckpunkte durch Winkel von 120 ° voneinander getrennt sind und senkrecht zu einem Balken stehen.
Und welche Rolle spielt das reine p-Orbital? Das Bilden einer Doppelbindung (=). Die sp-Orbitalezwei erlauben die Bildung von drei σ-Bindungen, während die reine p-Orbital-eine π-Bindung (eine Doppel- oder Dreifachbindung impliziert eine oder zwei π-Bindungen).
Zum Beispiel, um die Carbonylgruppe und die Struktur des Formaldehydmoleküls (H.zweiC = O) geht es wie folgt weiter:
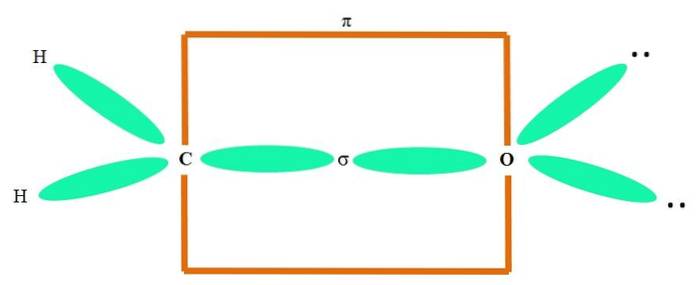
Die sp-Orbitalezwei sowohl C als auch O bilden eine σ-Bindung, während ihre reinen Orbitale eine π-Bindung bilden (das orangefarbene Rechteck).
Es ist zu sehen, wie sich die übrigen elektronischen Gruppen (H-Atome und ungeteilte Elektronenpaare) in den anderen sp-Orbitalen befinden.zwei, durch 120º getrennt.
Sp-Hybridisierung
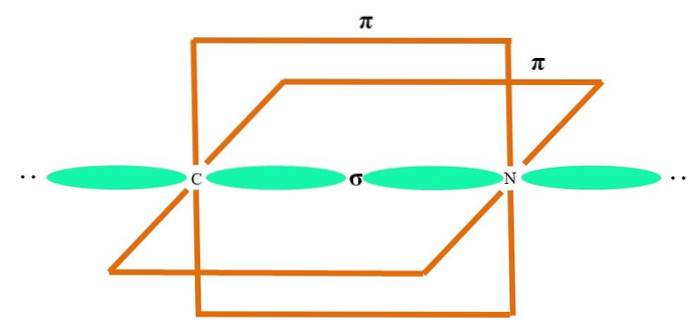
Im oberen Bild ist ein A-Atom mit sp-Hybridisierung dargestellt. Hier ergeben ein s-Orbital und ein p-Orbital zusammen zwei entartete sp-Orbitale. Jetzt bleiben jedoch zwei reine p-Orbitale unverändert, wodurch A zwei Doppelbindungen oder eine Dreifachbindung (≡) bilden kann..
Mit anderen Worten: Wenn ein C in einer Struktur (= C = oder C≡C) den obigen Bestimmungen entspricht, ist seine Hybridisierung sp. Für andere weniger anschauliche Atome - wie Übergangsmetalle - ist die Beschreibung elektronischer und molekularer Geometrien kompliziert, da auch die d-Orbitale und sogar die f-Orbitale berücksichtigt werden..
Die Hybridorbitale sind 180 ° voneinander entfernt. Aus diesem Grund sind die gebundenen Atome in einer linearen Molekülgeometrie (B-A-B) angeordnet. Schließlich zeigt das untere Bild die Struktur des Cyanidanions:
Verweise
- Sven. (03. Juni 2006). S-p-Orbitale. [Zahl]. Abgerufen am 24. Mai 2018 von: commons.wikimedia.org
- Richard C. Banks. (Mai 2002). Bindung und Hybridisierung. Abgerufen am 24. Mai 2018 von: chemistry.boisestate.edu
- James. (2018). Eine Hybridisierungsverknüpfung. Abgerufen am 24. Mai 2018 von: masterorganicchemistry.com
- Dr. Ian Hunt. Institut für Chemie, Universität von Calgary. sp3-Hybridisierung. Abgerufen am 24. Mai 2018 von: chem.ucalgary.ca
- Chemische Bindung II: Molekulargeometrie und Hybridisierung von Atomorbitalen Kapitel 10. [PDF]. Abgerufen am 24. Mai 2018 von: wou.edu
- Quimitube. (2015). Kovalente Bindung: Eine Einführung in die Atomorbitalhybridisierung. Abgerufen am 24. Mai 2018 von: quimitube.com
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Ausgabe, S. 51). Mc Graw Hill.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.