
Kohäsionskraft

Was sind Kohäsionskräfte??
Das Kohäsionskräfte Sie sind die intermolekularen Anziehungskräfte, die Moleküle zusammenhalten. Je nach Intensität der Kohäsionskräfte befindet sich eine Substanz in einem festen, flüssigen oder gasförmigen Zustand. Der Wert der Kohäsionskräfte ist eine intrinsische Eigenschaft jeder Substanz.
Diese Eigenschaft hängt mit der Form und Struktur der Moleküle jeder Substanz zusammen. Ein wichtiges Merkmal der Kohäsionskräfte ist, dass sie mit zunehmender Entfernung schnell abnehmen. Kohäsionskräfte werden dann als Anziehungskräfte bezeichnet, die zwischen den Molekülen derselben Substanz auftreten.
Das abstoßende Kräfte sind solche, die sich aus der kinetischen Energie (Energie aufgrund von Bewegung) der Teilchen ergeben. Diese Energie bewirkt, dass die Moleküle ständig in Bewegung sind. Die Intensität dieser Bewegung ist direkt proportional zur Temperatur, bei der sich die Substanz befindet..
Um die Zustandsänderung eines Stoffes zu bewirken, muss seine Temperatur durch Wärmeübertragung erhöht werden. Dies führt dazu, dass die Abstoßungskräfte der Substanz zunehmen, was im Fall davon ausgehen kann, dass die Zustandsänderung stattfindet..
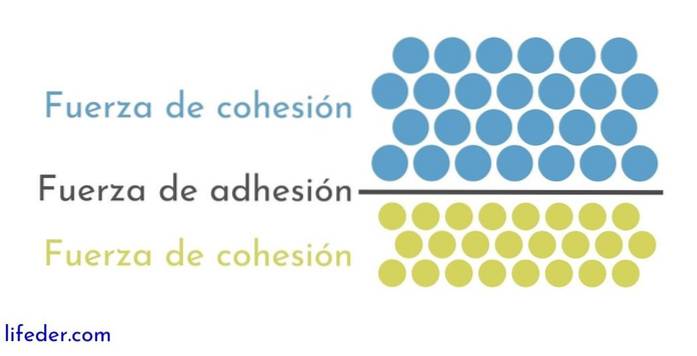
Andererseits ist es wichtig und notwendig, zwischen zu unterscheiden Zusammenhalt und Adhäsion::
- Die Kohäsion beruht auf den Anziehungskräften, die zwischen benachbarten Partikeln derselben Substanz auftreten.
- Die Adhäsion ist das Ergebnis der Wechselwirkung zwischen Oberflächen verschiedener Substanzen oder Körper.
Diese beiden Kräfte scheinen in verschiedenen physikalischen Phänomenen, die sich auf Flüssigkeiten auswirken, miteinander verbunden zu sein. Daher ist ein gutes Verständnis beider Kräfte wichtig..
Kohäsionskräfte in Feststoffen, Flüssigkeiten und Gasen

In Feststoffen
In Festkörpern sind die Kohäsionskräfte im Allgemeinen sehr hoch und treten in den drei Raumrichtungen intensiv auf..
Auf diese Weise finden nur geringe Verschiebungen der Moleküle zueinander statt, wenn eine äußere Kraft auf einen festen Körper ausgeübt wird..
Wenn die äußere Kraft verschwindet, sind die Kohäsionskräfte stark genug, um die Moleküle in ihre ursprüngliche Position zurückzubringen und die Position vor dem Aufbringen der Kraft wiederherzustellen..
In Flüssigkeiten
Im Gegensatz dazu sind in Flüssigkeiten die Kohäsionskräfte nur in zwei der Raumrichtungen hoch, während sie zwischen den Flüssigkeitsschichten sehr schwach sind..
Wenn also eine Kraft in tangentialer Richtung auf eine Flüssigkeit ausgeübt wird, bricht diese Kraft die schwachen Bindungen zwischen den Schichten. Dadurch gleiten die Flüssigkeitsschichten übereinander..
Später, wenn die Anwendung der Kraft beendet ist, haben die Kohäsionskräfte nicht genug Kraft, um die Moleküle der Flüssigkeit in ihre ursprüngliche Position zurückzubringen..
Darüber hinaus spiegelt sich die Kohäsion in Flüssigkeiten auch in der Oberflächenspannung wider, die durch eine unausgeglichene Kraft verursacht wird, die auf das Innere der Flüssigkeit gerichtet ist und auf die Oberflächenmoleküle wirkt..
Ebenso wird Kohäsion auch beobachtet, wenn der Übergang vom flüssigen in den festen Zustand aufgrund des Effekts der Kompression der Moleküle der Flüssigkeit auftritt..
In Gasen
In Gasen sind die Kohäsionskräfte vernachlässigbar. Auf diese Weise sind die Gasmoleküle in ständiger Bewegung, da in ihrem Fall die Kohäsionskräfte sie nicht zusammenhalten können..
Aus diesem Grund können in Gasen die Kohäsionskräfte nur dann erkannt werden, wenn der Verflüssigungsprozess stattfindet, der stattfindet, wenn die gasförmigen Moleküle komprimiert werden und die Anziehungskräfte stark genug sind, um den Übergang des Zustands vom gasförmigen zum flüssigen Zustand zu bewirken.
Beispiele für Kohäsionskräfte
Kohäsionskräfte verbinden sich häufig mit Adhäsionskräften, um bestimmte physikalische und chemische Phänomene hervorzurufen.
Beispielsweise erklären Kohäsionskräfte zusammen mit Adhäsionskräften einige der häufigsten Phänomene, die in Flüssigkeiten auftreten. ist der Fall des Meniskus, der Oberflächenspannung und der Kapillarität.
Daher ist es im Fall von Flüssigkeiten notwendig, zwischen den Kohäsionskräften zu unterscheiden, die zwischen den Molekülen derselben Flüssigkeit auftreten; und solche der Adhäsion, die zwischen den Molekülen der Flüssigkeit und des Feststoffs auftreten.
Oberflächenspannung

Die Oberflächenspannung ist die Kraft, die tangential und pro Längeneinheit am Rand der freien Oberfläche einer Flüssigkeit auftritt, die sich im Gleichgewicht befindet. Diese Kraft zieht die Oberfläche der Flüssigkeit zusammen.
Letztendlich tritt eine Oberflächenspannung auf, weil die Kräfte in den Molekülen der Flüssigkeit auf der Oberfläche der Flüssigkeit anders sind als auf der Innenseite..
Meniskus
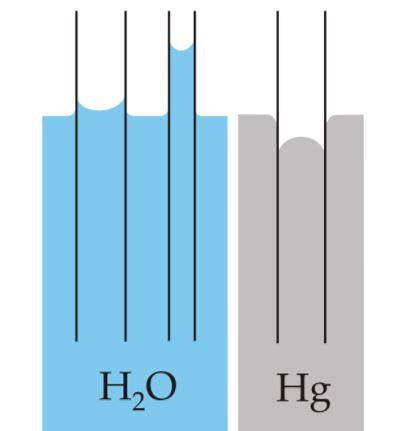
Meniskus ist die Krümmung, die auf der Oberfläche von Flüssigkeiten entsteht, wenn diese in einem Behälter eingeschlossen sind. Diese Kurve wird durch den Effekt erzeugt, den die Oberfläche des Behälters, der sie enthält, auf die Flüssigkeit hat..
Die Kurve kann konvex oder konkav sein, je nachdem, ob die Kraft zwischen den Molekülen der Flüssigkeit und denen des Behälters attraktiv ist - wie dies bei Wasser und Glas der Fall ist - oder abstoßend ist, wie es zwischen Quecksilber und Glas auftritt..
Kapillarität

Kapillarität ist eine Eigenschaft von Flüssigkeiten, die es ihnen ermöglicht, durch ein Kapillarröhrchen auf- oder abzusteigen. Es ist die Eigenschaft, die teilweise das Aufsteigen von Wasser innerhalb der Pflanzen ermöglicht.
Eine Flüssigkeit steigt im Kapillarröhrchen auf, wenn die Kohäsionskräfte geringer sind als die Adhäsionskräfte zwischen der Flüssigkeit und den Wänden des Röhrchens. Auf diese Weise steigt die Flüssigkeit weiter an, bis der Wert der Oberflächenspannung dem Gewicht der im Kapillarröhrchen enthaltenen Flüssigkeit entspricht..
Wenn im Gegensatz dazu die Kohäsionskräfte größer als die Adhäsionskräfte sind, verringert die Oberflächenspannung die Flüssigkeit und die Form ihrer Oberfläche ist konvex..
Verweise
- Kohäsion (Chemie) (n.d.). In Wikipedia. Von en.wikipedia.org wiederhergestellt.
- Oberflächenspannung (n.d.). In Wikipedia. Von en.wikipedia.org wiederhergestellt.
- Kapillarität (n.d.). In Wikipedia. Von es.wikipedia.org wiederhergestellt.
- Ira N. Levine; "Physicochemistry" Volume 1; Fünfte Ausgabe; 2004; Mc Graw Hillm.
- Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. (2005). Chemie: Die Molekularwissenschaft. Belmont, Kalifornien: Brooks / Cole.
- White, Harvey E. (1948). Moderne Hochschulphysik. van Nostrand.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.