
Ethylenglykoleigenschaften, chemische Struktur, Verwendung
Das Ethylenglykol Es ist die einfachste organische Verbindung in der Glykolfamilie. Seine chemische Formel lautet C.zweiH.6ODERzwei, während seine Strukturformel HOCH istzwei-CHzweiOH. Ein Glykol ist ein Alkohol, der dadurch gekennzeichnet ist, dass zwei Hydroxylgruppen (OH) an zwei benachbarte Kohlenstoffatome in einer aliphatischen Kette gebunden sind.
Ethylenglykol ist eine klare, farblose und geruchlose Flüssigkeit. Im Bild unten haben Sie eine Probe von ihm in einem Glas. Darüber hinaus hat es einen süßen Geschmack und ist sehr hygroskopisch. Da es sich um eine leicht flüchtige Flüssigkeit handelt, übt sie einen sehr geringen Dampfdruck aus, wobei die Dichte des Dampfes größer ist als die Dichte der Luft..

Ethylenglykol ist eine Verbindung mit großer Wasserlöslichkeit und mit vielen organischen Verbindungen mischbar. wie kurzkettige aliphatische Alkohole, Aceton, Glycerin usw. Dies ist auf ihre Fähigkeit zurückzuführen, Wasserstoffbrückenbindungen von protischen Lösungsmitteln (die H haben) zu spenden und zu akzeptieren..
Ethylenglykol polymerisiert zu vielen Verbindungen, deren Namen häufig mit PEG abgekürzt werden und deren Zahl das ungefähre Molekulargewicht angibt. PEG 400 ist beispielsweise ein relativ kleines flüssiges Polymer. Während große PEGs weiße Feststoffe mit einem fettigen Aussehen sind.
Die Eigenschaft von Ethylenglykol, den Schmelzpunkt zu senken und den Siedepunkt von Wasser zu erhöhen, ermöglicht seine Verwendung als Kühlmittel und Antikoagulans in Fahrzeugen, Flugzeugen und Computerausrüstung.
Artikelverzeichnis
- 1 Eigenschaften
- 1.1 Namen
- 1,2 Molmasse
- 1.3 Aussehen
- 1.4 Geruch
- 1,5 Geschmack
- 1.6 Dichte
- 1.7 Schmelzpunkt
- 1,8 Siedepunkt
- 1.9 Löslichkeit in Wasser
- 1.10 Löslichkeit in anderen Lösungsmitteln
- 1.11 Flammpunkt
- 1.12 Dampfdichte
- 1.13 Dampfdruck
- 1.14 Zersetzung
- 1.15 Lagertemperatur
- 1.16 Verbrennungswärme
- 1.17 Verdampfungswärme
- 1.18 Oberflächenspannung
- 1.19 Brechungsindex
- 1.20 Dissoziationskonstante
- 1,21 pH
- 1,22 Octanol / Wasser-Verteilungskoeffizient
- 2 Chemische Struktur
- 3 Produktion
- 3.1 Oxidation von Ethylen
- 3.2 Hydrolyse von Ethylenoxid
- 3.3 Omega-Prozess
- 4 Verwendungen
- 4.1 Kühlmittel und Frostschutzmittel
- 4.2 Dehydration
- 4.3 Herstellung von Polymeren
- 4.4 Sprengstoffe
- 4.5 Holzschutz
- 4.6 Andere Anwendungen
- 5 Vergiftungen und Risiken
- 5.1 Symptome durch Exposition
- 5.2 Verschluckungsschaden
- 5.3 Ökologische Folgen von Ethylenglykol
- 6 Referenzen
Eigenschaften
Namen
Ethan-1,2-diol (IUPAC), Ethylenglykol, Monoethylenglykol (MEG), 1-2-Dihydroxyethan.
Molmasse
62,068 g / mol
Aussehen
Klare, farblose und viskose Flüssigkeit.
Geruch
Toilette
Geschmack
Süßigkeiten
Dichte
1,1132 g / cm3
Schmelzpunkt
-12,9 ºC
Siedepunkt
197,3 ºC
Wasserlöslichkeit
Mit Wasser mischbar, stark hygroskopische Verbindung.
Löslichkeit in anderen Lösungsmitteln
Mischbar mit niederen aliphatischen Alkoholen (Methanol und Ethanol), Glycerin, Essigsäure, Aceton und ähnlichen Ketonen, Aldehyden, Pyridin, Kohlenteerbasen und löslich in Ether. Praktisch unlöslich in Benzol und seinen Homologen, chlorierten Kohlenwasserstoffen, Petrolether und Ölen.
Zündpunkt
111 ºC
Wasserdampfdichte
2.14 in Bezug auf Luft als 1 genommen.
Dampfdruck
0,092 mmHg bei 25 ° C (durch Extrapolation).
Zersetzung
Wenn es zur Zersetzung erhitzt wird, gibt es scharfen und reizenden Rauch ab.
Lagertemperatur
2-8 ºC
Verbrennungswärme
1.189,2 kJ / mol
Verdampfungswärme
50,5 kJ / mol
Oberflächenspannung
47,99 mN / m bei 25 ºC
Brechungsindex
1,4318 bei 20 ºC
Dissoziationskonstante
pKa = 14,22 bei 25 ° C.
pH
6 bis 7,5 (100 g / l Wasser) bei 20 ºC
Octanol / Wasser-Verteilungskoeffizient
Log P = - 1,69
Chemische Struktur
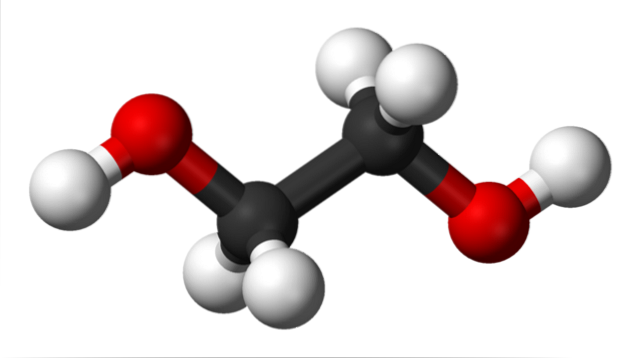
Im oberen Bild sehen wir das Ethylenglykolmolekül, das durch ein Modell von Kugeln und Balken dargestellt wird. Die schwarzen Kugeln entsprechen den Kohlenstoffatomen, aus denen ihr C-C-Gerüst besteht, und an ihren Enden haben wir die roten und weißen Kugeln für die Sauerstoff- bzw. Wasserstoffatome..
Es ist ein symmetrisches Molekül und auf den ersten Blick kann man annehmen, dass es ein permanentes Dipolmoment hat; Ihre C-OH-Bindungen drehen sich jedoch, was den Dipol begünstigt. Es ist auch ein dynamisches Molekül, das konstanten Rotationen und Vibrationen ausgesetzt ist und dank seiner beiden OH-Gruppen Wasserstoffbrückenbindungen bilden oder empfangen kann..
Tatsächlich sind diese Wechselwirkungen für Ethylenglykol mit einem so hohen Siedepunkt (197 ºC) verantwortlich..
Wenn die Temperatur auf -13 ºC fällt, verschmelzen die Moleküle in einem orthorhombischen Kristall, in dem Rotamere eine wichtige Rolle spielen. Das heißt, es gibt Moleküle, deren O-H-Gruppen in verschiedene Richtungen ausgerichtet sind.
Produktion
Ethylenoxidation
Der erste Schritt bei der Synthese von Ethylenglykol ist die Oxidation von Ethylen zu Ethylenoxid. In der Vergangenheit wurde Ethylen mit Hypochlorsäure umgesetzt, um Chlorhydrin herzustellen. Dies wurde dann mit Calciumhydroxid behandelt, um Ethylenoxid herzustellen..
Das Chlorhydrin-Verfahren ist nicht sehr rentabel und ein Verfahren zur direkten Oxidation von Ethylen in Gegenwart von Luft oder Sauerstoff wurde unter Verwendung von Silberoxid als Katalysator umgestellt..
Ethylenoxidhydrolyse
Die Hydrolyse von Ethylenoxid (EO) mit Wasser unter Druck ergibt eine rohe Mischung. Das Wasser-Glykol-Gemisch wird eingedampft und recycelt, wobei Monoethylenglykol durch fraktionierte Destillation von Diethylenglykol und Triethylenglykol getrennt wird..
Die Ethylenoxidhydrolysereaktion kann wie folgt umrissen werden:
C.zweiH.4O + H.zweiO => OH-CHzwei-CHzwei-OH (Ethylenglykol oder Monoethylenglykol)
Mitsubishi Chemical entwickelte unter Verwendung von Phosphor ein katalytisches Verfahren zur Umwandlung von Ethylenoxid in Monoethylenglykol.
Omega-Prozess
Beim Omega-Verfahren wird Ethylenoxid zunächst durch seine Reaktion mit Kohlendioxid (CO) in Ethylencarbonat umgewandeltzwei). Dann wird das Ethylencarbonat einer katalytischen Hydrolyse unterzogen, um das Monoethylenglykol mit 98% Selektivität zu erhalten.
Es gibt eine relativ neue Methode zur Synthese von Ethylenglykol. Dies besteht aus der oxidativen Carbonylierung von Methanol zu Dimethyloxalat (DMO) und seiner anschließenden Hydrierung zu Ethylenglykol..
Anwendungen
Kühlmittel und Frostschutzmittel
Die Mischung von Ethylenglykol mit Wasser ermöglicht eine Verringerung des Gefrierpunkts und eine Erhöhung des Siedepunkts, so dass Automotoren im Winter nicht gefrieren und im Sommer nicht überhitzen können.
Wenn der Prozentsatz an Ethylenglykol in der Mischung mit Wasser 70% erreicht, beträgt der Gefrierpunkt -55 ºC, so dass die Ethylenglykol-Wasser-Mischung als Kühlflüssigkeit verwendet werden kann und unter den Bedingungen, unter denen sie auftreten kann, vor dem Einfrieren geschützt werden kann.
Die niedrigen Gefriertemperaturen von Ethylenglykollösungen ermöglichen die Verwendung als Frostschutzmittel in Kraftfahrzeugmotoren. Enteisung von Flugzeugflügeln; und beim Enteisen der Windschutzscheiben.
Es wird auch verwendet, um bei niedrigen Temperaturen aufbewahrte biologische Proben aufzubewahren, wodurch die Bildung von Kristallen vermieden wird, die die Struktur der Proben beschädigen können..
Der hohe Siedepunkt ermöglicht die Verwendung von Ethylenglykollösungen zur Aufrechterhaltung niedriger Temperaturen in Geräten oder Ausrüstungen, die beim Betrieb Wärme erzeugen, wie z. B. Autos, Computerausrüstung, Klimaanlagen usw..
Dehydration
Ethylenglykol ist eine sehr hygroskopische Verbindung, die es ermöglicht hat, Gase zu behandeln, die aus dem Untergrund extrahiert wurden und einen hohen Gehalt an Wasserdämpfen aufweisen. Die Beseitigung von Wasser aus Erdgasen begünstigt deren effiziente Verwendung in ihren jeweiligen industriellen Prozessen..
Polymerherstellung
Ethylenglykol wird zur Synthese von Polymeren wie Polyethylenglykol (PEG), Polyethylenterephthalat (PET) und Polyurethan verwendet. PEGs sind eine Familie von Polymeren, die in Anwendungen wie Lebensmittelverdickung, Verstopfungsbehandlung, Kosmetika usw. verwendet werden..
PET wird zur Herstellung von Einwegbehältern aller Art verwendet, die in verschiedenen Arten von Getränken und Lebensmitteln verwendet werden. Polyurethan wird als Wärmeisolator in Kühlschränken und als Füllstoff in verschiedenen Möbeltypen verwendet.
Sprengstoff
Es wird bei der Herstellung von Dynamit verwendet, wodurch es durch eine Verringerung des Gefrierpunkts von Nitroglycerin mit geringerem Risiko gelagert werden kann..
Holzschutz
Ethylenglykol wird zur Behandlung von Holz verwendet, um es vor seiner Fäulnis zu schützen, die durch die Einwirkung von Pilzen erzeugt wird. Dies ist wichtig für die Erhaltung von Museumskunstwerken.
Andere Apps
Ethylenglykol ist in Medien zum Suspendieren leitfähiger Salze in Elektrolytkondensatoren und in Sojaschaumstabilisatoren vorhanden. Es wird auch zur Herstellung von Weichmachern, Elastomeren und synthetischen Wachsen verwendet.
Ethylenglykol wird zur Trennung von aromatischen und paraffinischen Kohlenwasserstoffen verwendet. Darüber hinaus wird es zur Herstellung von Reinigungsmitteln für Reinigungsgeräte verwendet. Erhöht die Viskosität und verringert die Flüchtigkeit der Tinte, wodurch die Verwendung vereinfacht wird.
Ethylenglykol kann auch in der Gießerei von Formsand und als Schmiermittel beim Schleifen von Glas und Zement verwendet werden. Es wird auch als Bestandteil in hydraulischen Bremsflüssigkeiten und als Zwischenprodukt bei der Synthese von Estern, Ethern, Polyesterfasern und Harzen verwendet..
Zu den Harzen, in denen Ethylenglykol als Rohstoff verwendet wird, gehört das Alkyd, das als Basis für Alkydfarben verwendet wird und in Automobil- und Architekturfarben verwendet wird..
Vergiftungen und Risiken
Symptome durch Exposition
Ethylenglykol hat eine geringe akute Toxizität, wenn es durch Hautkontakt oder Einatmen wirkt. Die Toxizität zeigt sich jedoch bei Einnahme vollständig und wird als tödliche Dosis Ethylenglykol von 1,5 g / kg Körpergewicht oder 100 ml bei einem Erwachsenen mit 70 kg angegeben..
Akute Exposition gegenüber Ethylenglykol führt zu folgenden Symptomen: Einatmen verursacht Husten, Schwindel und Kopfschmerzen. Auf der Haut tritt durch Kontakt mit Ethylenglykol Trockenheit auf. Währenddessen erzeugt es in den Augen Rötungen und Schmerzen.
Verschluckungsschaden
Die Einnahme von Ethylenglykol äußert sich in Bauchschmerzen, Übelkeit, Bewusstlosigkeit und Erbrechen. Eine übermäßige Aufnahme von Ethylenglykol hat schädliche Auswirkungen auf das Zentralnervensystem (ZNS), die Herz-Kreislauf-Funktion sowie die Nierenmorphologie und -physiologie..
Aufgrund von Funktionsstörungen des ZNS kommt es zu Lähmungen oder unregelmäßigen Augenbewegungen (Nystagmus). Im kardiopulmonalen System gibt es hohen Blutdruck, Tachykardie und mögliche Herzinsuffizienz. Es gibt schwerwiegende Veränderungen in der Niere, die auf die Vergiftung mit Ethylenglykol zurückzuführen sind.
Dilatation, Degeneration und Calciumoxalatablagerung treten in den Nierentubuli auf. Letzteres wird durch den folgenden Mechanismus erklärt: Ethylenglykol wird durch das Milchsäuredehydrogenaseenzym unter Bildung von Glykoaldehyd metabolisiert.
Glycoaldehyd führt zu Glycol-, Glyoxyl- und Oxalsäure. Oxalsäure fällt schnell mit Calcium aus und bildet Calciumoxalat, dessen unlösliche Kristalle sich in den Nierentubuli ablagern und morphologische Veränderungen und Funktionsstörungen hervorrufen, die zu Nierenversagen führen können..
Aufgrund der Toxizität von Ethylenglykol wurde es in einigen seiner Anwendungen allmählich durch Propylenglykol ersetzt.
Ökologische Folgen von Ethylenglykol
Während ihrer Enteisung setzen Flugzeuge erhebliche Mengen an Ethylenglykol frei, die sich auf den Landebahnen ansammeln. Beim Waschen führt das Wasser dazu, dass das Wasser das Ethylenglykol über das Abwassersystem in die Flüsse überträgt, wo seine Toxizität die Lebensdauer von beeinflusst das Flugzeug. Fisch.
Die Toxizität von Ethylenglykol ist jedoch an sich nicht die Hauptursache für ökologische Schäden. Während des aeroben biologischen Abbaus wird eine erhebliche Menge Sauerstoff verbraucht, was zu einer Abnahme des Oberflächenwassers führt.
Andererseits kann sein anaerober biologischer Abbau toxische Substanzen für Fische wie Acetaldehyd, Ethanol, Acetat und Methan freisetzen..
Verweise
- Wikipedia. (2019). Ethylenglykol. Wiederhergestellt von: en.wikipedia.org
- Nationales Zentrum für Informationen zur Biotechnologie. PubChem-Datenbank. (2019). 1,2-Ethandiol. CID = 174. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Artem Cheprasov. (2019). Ethylenglykol: Struktur, Formel und Verwendung. Studie. Wiederhergestellt von: study.com
- Leroy G. Wade. (27. November 2018). Ethylenglykol. Encyclopædia Britannica. Wiederhergestellt von: britannica.com
- A. Dominic Fortes und Emmanuelle Suard. (2011). Kristallstrukturen von Ethylenglykol und Ethylenglykolmonohydrat. J. Chem. Phys. 135, 234501. doi.org/10.1063/1.3668311
- Icis. (24. Dezember 2010). Produktions- und Herstellungsverfahren für Ethylenglykol (EG). Wiederhergestellt von: icis.com
- Lucy Bell Young. (2019). Was sind die Verwendungen von Ethylenglykol? Reagens. Wiederhergestellt von: Chemicals.co.uk
- QuimiNet. (2019). Herkunft, Art und Anwendung von Ethylenglykolen. Wiederhergestellt von: quiminet.com
- R. Gomes, R. Liteplo & M.E. Sanftmütig. (2002). Ethylenglykol: Aspekte der menschlichen Gesundheit. Weltgesundheitsorganisation Genf. [PDF]. Wiederhergestellt von: who.int



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.