
Epimereigenschaften, Bildung und Beispiele
Das Epimere Sie sind Diastereoisomere, bei denen sich nur eines ihrer achiralen Zentren in der räumlichen Konfiguration unterscheidet. Im Gegensatz zu Enantiomeren, bei denen alle achiralen Zentren unterschiedliche Konfigurationen aufweisen und ein Paar von Spiegelbildern darstellen, die sich nicht überlagern können.
Der Rest der Diastereoisomere (z. B. geometrische Isomere) kann mehr als zwei Zentren mit unterschiedlichen Konfigurationen aufweisen. Daher ist ein großer Prozentsatz der Stereoisomere Diastereoisomere; Epimere sind zwar viel weniger, aber nicht aus diesem Grund weniger wichtig.
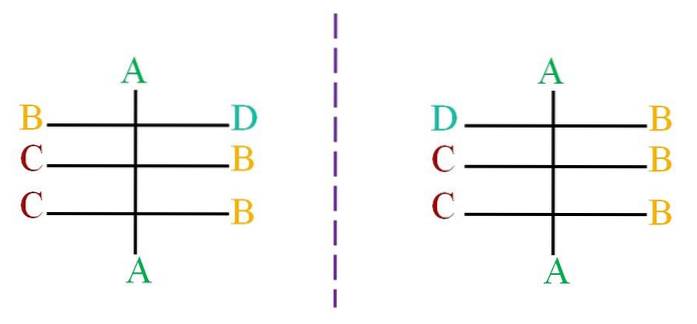
Angenommen, eine Struktur mit einem Skelett schwarzer Atome ist mit den Buchstaben A, B, C und D verbunden (oberes Bild). Die gepunktete Linie stellt den Spiegel dar und zeigt, dass das obige Molekülpaar keine Enantiomere sind, da alle ihre chiralen Zentren dieselbe Konfiguration haben. außer dem ersten Zentrum, das mit den Buchstaben B und D verbunden ist.
Das Molekül auf der linken Seite zeigt den Buchstaben D auf der rechten Seite, während der Molekülbuchstabe D auf der rechten Seite auf die linke Seite zeigt. Verwenden Sie das Cahn-Ingold-Prelog-System (R-S), um zu wissen, wie die einzelnen Konfigurationen aussehen werden..
Artikelverzeichnis
- 1 Eigenschaften von Epimeren
- 2 Schulung
- 2.1 Tautomerisierung
- 3 Beispiele
- 3.1 Glucoseanomere
- 3.2 Isomere von Menthol
- 4 Referenzen
Eigenschaften von Epimeren
Das Hauptmerkmal von Epimeren liegt ausschließlich in einem achiralen (oder stereogenen) Zentrum. Das Ändern der räumlichen Ausrichtung von D und B kann zu stabileren oder instabileren Konformern führen. Das heißt, die Rotationen der Einfachbindungen bewirken, dass sich zwei Atome oder Gruppen sperriger Atome treffen oder wegbewegen.
Aus dieser Perspektive kann ein Epimer viel stabiler sein als das andere. Dasjenige, das durch Drehen seiner Bindungen stabilere Strukturen erzeugt, ist das Epimer mit der größten Tendenz, sich im Gleichgewicht zu bilden..
Zurück zu den Buchstaben: D und B können sehr sperrig sein, während C ein kleines Atom ist. In diesem Fall ist das Epimer rechts stabiler, da D und C links von den ersten beiden Zentren weniger sterisch behindert sind..
Mikroskopisch wird dies ein Merkmal für das betrachtete Epimerepaar; Makroskopisch werden die Unterschiede jedoch akzentuiert und weisen beispielsweise unterschiedliche Schmelzpunkte, Brechungsindizes und NMR-Spektren auf (zusätzlich zu vielen anderen Eigenschaften)..
Auf dem Gebiet der Biologie und enzymkatalysierten Reaktionen unterscheiden sich Epimere hier jedoch noch mehr. Einer könnte vom Körper metabolisiert werden, der andere nicht.
Ausbildung
Wie entstehen Epimere? Durch eine chemische Reaktion namens Epimerisierung. Wenn sich beide Epimere in ihrer Stabilität nicht stark unterscheiden, wird ein Epimerisierungsgleichgewicht hergestellt, das nichts weiter als eine gegenseitige Umwandlung ist:
EpA <=> EpB
Wenn EpA Epimer A ist und EpB Epimer B ist. Wenn einer von ihnen viel stabiler als der andere ist, hat er eine höhere Konzentration und verursacht eine sogenannte Mutarotation. Das heißt, es kann die Richtung eines polarisierten Lichtstrahls ändern.
Die Epimerisierung ist möglicherweise nicht im Gleichgewicht und daher irreversibel. In diesen Fällen wird eine racemische Mischung von EpA / EpB-Diastereomeren erhalten..
Der Syntheseweg der Epimere variiert in Abhängigkeit von den beteiligten Reagenzien, dem Reaktionsmedium und den Prozessvariablen (Verwendung von Katalysatoren, Druck, Temperatur usw.)..
Aus diesem Grund muss die Bildung jedes Epimerpaares einzeln von den anderen untersucht werden; jedes mit seinen eigenen chemischen Mechanismen und Systemen.
Tautomerisierung
Von allen Epimerbildungsprozessen kann die Tautomerisierung von zwei Diastereoisomeren als allgemeines Beispiel angesehen werden..
Dies besteht aus einem Gleichgewicht, in dem das Molekül eine Keton- (C = O) oder Enol- (C-OH) Form annimmt. Sobald die Ketonform wieder umgewandelt ist, ändert sich die Konfiguration des Kohlenstoffs neben der Carbonylgruppe (wenn chiral), wodurch ein Paar Epimere erzeugt wird.
Ein Beispiel für das oben erwähnte ist das cis-Decalone- und das Trans-Decalone-Paar.
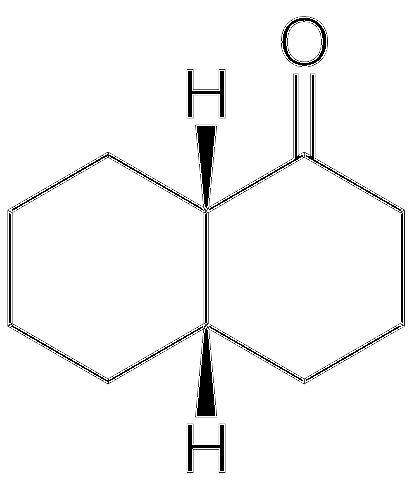
Die Struktur von cis-Decalon ist oben gezeigt. Die H-Atome befinden sich oben auf den beiden Ringen; Im Trans-Decalone befindet sich einer über den Ringen und der andere unter. Der Kohlenstoff links von der C = O-Gruppe ist das chirale Zentrum und daher dasjenige, das die Epimere unterscheidet.
Beispiele
Glucoseanomere
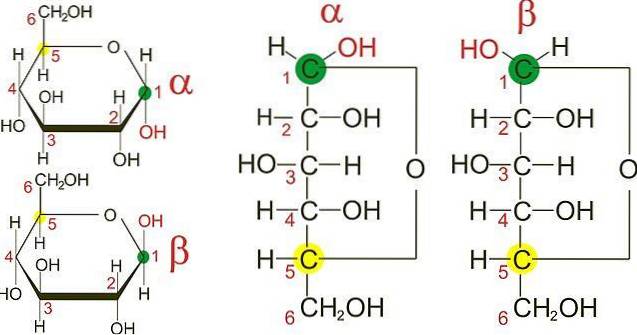
Das obere Bild zeigt die Furanringe der beiden Anomere von D-Glucose: α und β. Aus den Ringen ist ersichtlich, dass sich die OH-Gruppen an Kohlenstoff 1 entweder in der gleichen Richtung wie das benachbarte OH, im α-Anomer oder in entgegengesetzten Richtungen wie im β-Anomer befinden..
Die Fisher-Projektionen beider Anomere (rechts im Bild) machen den Unterschied zwischen den beiden Epimeren, die selbst Anomere sind, noch deutlicher. Zwei α-Anomere können jedoch unterschiedliche räumliche Konfigurationen an einem der anderen Kohlenstoffe aufweisen und daher Epimere sein..
In C-1 der Fisher-Projektion für das α-Anomer "schaut" die OH-Gruppe nach rechts, während sie im β-Anomer nach links "schaut"..
Isomere von Menthol

Im Bild haben Sie alle Stereoisomere des Mentholmoleküls. Jede Spalte stellt ein Paar von Enantiomeren dar (genau beobachten), während die Zeilen den Diastereomeren entsprechen.
Was sind Epimere? Sie müssen diejenigen sein, die sich in der räumlichen Position eines einzelnen Kohlenstoffs kaum unterscheiden..
(+) - Menthol und (-) - Neoisomenthol sind Epimere und darüber hinaus Diastereoisomere (sie befinden sich nicht in derselben Spalte). Wenn im Detail beobachtet, sowohl in der -OH- als auch in der -CH-Gruppe3 kommen aus der Ebene (über dem Ring), aber im (-) - Neoisomenthol zeigt auch die Isopropylgruppe aus der Ebene.
Nicht nur (+) - Menthol ist das Epimer von (-) - Neoisomenthol, sondern auch (+) - Neomenthol. Letzteres unterscheidet sich nur darin, dass die Gruppe -CH3 zeigt auf das Flugzeug. Andere Epimere sind:
-(-) - Isomenthol und (-) - Neomenthol
-(+) - Isomenthol und (+) - Neomenthol
-(+) - Neoisomenthol und (-) - Neomenthol
-(+) - Neomenthol und (-) - Neoisomenthol
Diese Stereoisomere stellen ein praktisches Beispiel dar, um das Konzept der Epimere zu verdeutlichen, und Sie können sehen, dass von mehreren Diastereoisomeren viele nur in einen einzigen asymmetrischen oder chiralen Kohlenstoff differenzieren können..
Verweise
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. (10th Auflage.). Wiley plus.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Uruguay Educa Klassenzimmer. (s.f.). Epimere. Wiederhergestellt von: aulas.uruguayeduca.edu.uy
- Wikipedia. (2018). Epimer. Wiederhergestellt von: en.wikipedia.org/wiki/Epimer
- Fray J. M. (2014). Untersuchung der Epimerbildung in Amidkupplungsreaktionen: Ein Experiment für fortgeschrittene Studenten. School of Chemistry, Universität Nottingham, University Park, Nottingham NG7 2RD, Vereinigtes Königreich. J. Chem. Educ. 2014, 91, 1, 136 & ndash; 140
- Reist & col. (1995). Racemisierung, Enantiomerisierung, Diastereomerisierung und Epimerisierung: ihre Bedeutung und pharmakologische Bedeutung. Chirality 7: 396 & ndash; 400.
Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.