
Chemische Aktivierungsenergie Woraus besteht sie, Berechnung

Das chemische Aktivierungsenergie (aus Sicht kinetischer Studien) bezieht sich auf die geringstmögliche Energiemenge, die zum Starten einer chemischen Reaktion erforderlich ist. Nach der Theorie der Kollisionen in der chemischen Kinetik sollen alle in Bewegung befindlichen Moleküle eine bestimmte Menge an kinetischer Energie haben.
Dies bedeutet, dass je größer die Geschwindigkeit seiner Bewegung ist, desto größer ist die Größe seiner kinetischen Energie. In diesem Sinne kann ein Molekül, das eine schnelle Bewegung trägt, nicht selbst in Fragmente unterteilt werden, sodass eine Kollision zwischen ihm und einem anderen Molekül auftreten muss, damit eine chemische Reaktion stattfinden kann..
Wenn dies geschieht - wenn es eine Kollision zwischen den Molekülen gibt - wird ein Bruchteil ihrer kinetischen Energie in Schwingungsenergie umgewandelt. Wenn zu Beginn des Prozesses die kinetische Energie hoch ist, zeigen die an der Kollision beteiligten Moleküle ebenfalls eine so große Schwingung, dass einige der vorhandenen chemischen Bindungen aufgebrochen werden..
Dieses Aufbrechen von Bindungen ist der erste Schritt bei der Umwandlung von Reaktanten in Produkte; das heißt, bei der Bildung dieser. Im Gegenteil, wenn zu Beginn dieses Prozesses die kinetische Energie von geringer Größe ist, gibt es ein Phänomen des "Rückpralls" der Moleküle, durch das sie praktisch intakt getrennt werden..
Artikelverzeichnis
- 1 Was macht?
- 1.1 Aktivierter Komplex
- 2 Wie wird es berechnet??
- 2.1 Berechnung der Aktivierungsenergie einer chemischen Reaktion
- 3 Wie wirkt sich Aktivierungsenergie auf die Reaktionsgeschwindigkeit aus??
- 4 Beispiele für die Berechnung der Aktivierungsenergie
- 5 Referenzen
Woraus besteht es?
Ausgehend von dem zuvor beschriebenen Konzept von Kollisionen zwischen Molekülen zur Auslösung chemischer Reaktionen kann gesagt werden, dass eine minimale Energiemenge erforderlich ist, damit eine Kollision auftritt..
Wenn also der Energiewert unter diesem notwendigen Minimum liegt, gibt es nach der Kollision einfach keine Veränderung zwischen den Molekülen. Wenn diese Energie fehlt, bleiben die beteiligten Spezies praktisch intakt und es kommt zu keiner Veränderung aufgrund dieses Absturzes.
In dieser Reihenfolge von Ideen wird die minimale Energie, die für eine Änderung nach einer Kollision zwischen Molekülen benötigt wird, als Aktivierungsenergie bezeichnet..
Mit anderen Worten, die an einer Kollision beteiligten Moleküle müssen eine Gesamtmenge an kinetischer Energie besitzen, die gleich oder größer als die Aktivierungsenergie ist, damit eine chemische Reaktion stattfinden kann..
Ebenso kollidieren die Moleküle in vielen Fällen und bilden eine neue Spezies, die als aktivierter Komplex bezeichnet wird. Diese Struktur wird auch als "Übergangszustand" bezeichnet, da sie nur vorübergehend existiert..
Es wird durch die Reaktantenspezies aufgrund der Kollision und vor der Bildung der Reaktionsprodukte verursacht.
Aktivierter Komplex
Der oben erwähnte aktivierte Komplex bildet eine Spezies, die eine sehr geringe Stabilität aufweist, aber wiederum eine große Menge an potentieller Energie aufweist..
Das folgende Diagramm zeigt die Umwandlung von Reaktanten in Produkte, ausgedrückt als Energie, und stellt fest, dass die Größe der Energie des gebildeten aktivierten Komplexes erheblich größer ist als die der Reaktanten und Produkte..
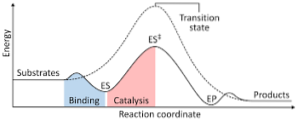
Wenn die Produkte am Ende der Reaktion eine größere Stabilität aufweisen als die Reaktantensubstanzen, erfolgt die Energiefreisetzung in Form von Wärme, was zu einer exothermen Reaktion führt..
Im Gegenteil, wenn die Reaktanten zu einer größeren Stabilität als die Produkte führen, bedeutet dies, dass das Reaktionsgemisch eine Absorption von Energie in Form von Wärme aus seiner Umgebung zeigt, was zu einer endothermen Reaktion führt..
Wenn der eine oder andere Fall eintritt, sollte ebenfalls ein Diagramm wie das zuvor gezeigte erstellt werden, in dem die potentielle Energie des Systems, das gegen den Fortschritt oder Fortschritt der Reaktion reagiert, aufgezeichnet wird..
Somit werden die potentiellen Energieänderungen erhalten, die auftreten, wenn die Reaktion fortschreitet und die Reaktanten in Produkte umgewandelt werden..
Wie wird es berechnet??
Die Aktivierungsenergie einer chemischen Reaktion hängt eng mit der Geschwindigkeitskonstante dieser Reaktion zusammen, und die Abhängigkeit dieser Konstante von der Temperatur wird durch die Arrhenius-Gleichung dargestellt:
k = Ae-Ea / RT
In diesem Ausdruck k repräsentiert die Geschwindigkeitskonstante der Reaktion (die von der Temperatur abhängt) und den Parameter ZU wird als Frequenzfaktor bezeichnet und ist ein Maß für die Häufigkeit von Kollisionen zwischen Molekülen.
Für seinen Teil, und drückt die Basis der Reihe natürlicher Logarithmen aus. Es wird auf eine Potenz angehoben, die dem negativen Quotienten der Aktivierungsenergie entspricht (Ea) zwischen dem Produkt, das sich aus der Gaskonstante ergibt (R.) und absolute Temperatur (T.) des zu berücksichtigenden Systems.
Es ist zu beachten, dass der Frequenzfaktor in bestimmten Reaktionssystemen über einen weiten Temperaturbereich als Konstante angesehen werden kann..
Dieser mathematische Ausdruck wurde ursprünglich 1884 vom niederländischen Chemiker Jacobus Henricus van't Hoff angenommen, aber derjenige, der ihm wissenschaftliche Gültigkeit verlieh und seine Prämisse interpretierte, war 1889 der schwedische Chemiker Svante Arrhenius.
Berechnung der Aktivierungsenergie einer chemischen Reaktion
Die Arrhenius-Gleichung gibt die direkte Proportionalität an, die zwischen der Geschwindigkeitskonstante einer Reaktion und der Häufigkeit von Kollisionen zwischen Molekülen besteht.
Ebenso kann diese Gleichung auf bequemere Weise dargestellt werden, indem die Eigenschaft natürlicher Logarithmen auf jede Seite der Gleichung angewendet wird, wobei erhalten wird:
ln k = ln A - Ea / RT
Durch Umordnen der Terme in Bezug auf das Erhalten der Gleichung einer Linie (y = mx + b) wird der folgende Ausdruck erreicht:
ln k = (- Ea / R) (1 / T) + ln A.
Wenn also ein Graph von ln k gegen 1 / T konstruiert wird, wird eine gerade Linie erhalten, wobei ln k die Koordinate darstellt und (-Ea / R) die Steigung der Linie (m) darstellt, (1 / T) darstellt die x-Koordinate und ln A repräsentiert den Achsenabschnitt mit der Ordinatenachse (b).
Wie zu sehen ist, ist die aus dieser Berechnung resultierende Steigung gleich dem Wert von -Ea / R. Dies bedeutet, dass Sie, wenn Sie den Wert der Aktivierungsenergie mithilfe dieses Ausdrucks erhalten möchten, eine einfache Klarstellung durchführen müssen, die Folgendes ergibt:
Ea = -mR
Hier ist der Wert von m bekannt und R ist eine Konstante von 8,314 J / K mol.
Wie wirkt sich Aktivierungsenergie auf die Reaktionsgeschwindigkeit aus??
Wenn versucht wird, ein Bild der Aktivierungsenergie zu erhalten, kann dies als Barriere betrachtet werden, die keine Reaktion zwischen den Molekülen mit niedrigerer Energie zulässt..
Wie bei einer üblichen Reaktion ist die Anzahl der Moleküle, die reagieren können, ziemlich groß. Die Geschwindigkeit - und entsprechend die kinetische Energie dieser Moleküle - kann sehr unterschiedlich sein.
Es kommt im Allgemeinen vor, dass nur ein kleiner Teil der Gesamtheit der Moleküle, die eine Kollision erfahren - diejenigen, die eine höhere Bewegungsgeschwindigkeit haben - über genügend kinetische Energie verfügen, um die Größe der Aktivierungsenergie überschreiten zu können. Diese Moleküle sind also fit und in der Lage, Teil der Reaktion zu sein.
Nach der Arrhenius-Gleichung impliziert das negative Vorzeichen, das dem Quotienten zwischen der Aktivierungsenergie und dem Produkt der Gaskonstante und der absoluten Temperatur vorausgeht, dass die Geschwindigkeitskonstante mit zunehmender Aktivierungsenergie abnimmt, sowie a Wachstum bei steigender Temperatur.
Beispiele für die Berechnung der Aktivierungsenergie
Um die Aktivierungsenergie durch Erstellen eines Graphen gemäß der Arrhenius-Gleichung zu berechnen, wurden die Geschwindigkeitskonstanten für die Zersetzungsreaktion von Acetaldehyd bei fünf verschiedenen Temperaturen gemessen, und es ist erwünscht, die Aktivierungsenergie für die Reaktion zu bestimmen, die ausgedrückt wird als:
CH3CHO (g) → CH4(g) + CO (g)
Die Daten für die fünf Messungen sind wie folgt:
k (1 / M.1/2S): 0,011 - 0,035 - 0,105 - 0,343 - 0,789
T (K): 700 - 730 - 760 - 790 - 810
Um dieses Unbekannte zu lösen und die Aktivierungsenergie zu bestimmen, muss zunächst ein Graph von ln k gegen 1 / T (y gegen x) erstellt werden, um eine gerade Linie zu erhalten und von hier aus die Steigung zu nehmen und den Wert von Ea zu ermitteln , wie erklärt.
Bei der Transformation der Messdaten gemäß der Arrhenius-Gleichung [ln k = (- Ea / R) (1 / T) + ln A] werden die folgenden Werte für y bzw. x gefunden:
In k: (-4,51) - (-3,35) - (-2,254) - (-1,070) - (-0,237)
1 / T (K.-1): 1,43 * 10-3 - 1,37 * 10-3 - 1,32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
Aus diesen Werten und mittels der mathematischen Berechnung der Steigung - entweder in einem Computer oder in einem Taschenrechner - mittels des Ausdrucks m = (Y.zwei-Y.1) / (X.zwei-X.1) oder unter Verwendung der linearen Regressionsmethode wird erhalten, dass m = -Ea / R = -2,09 * 10 ist4 K. Also:
Ea = (8,314 J / K mol) (2,09 · 104 K)
= 1,74 * 105 = 1,74 * 10zwei kJ / mol
Um andere Aktivierungsenergien grafisch zu bestimmen, wird ein ähnliches Verfahren durchgeführt.
Verweise
- Wikipedia. (s.f.). Aktivierungsenergie. Von en.wikipedia.org wiederhergestellt
- Chang, R. (2007). Chemie, 9. Auflage. Mexiko: McGraw-Hill.
- Britannica, E. (s.f.). Aktivierungsenergie. Von britannica.com abgerufen
- Moore, J. W. und Pearson, R. G. (1961). Kinetik und Mechanismus. Von books.google.co.ve wiederhergestellt
- Kaesche, H. (2003). Korrosion von Metallen: Physikochemische Prinzipien und aktuelle Probleme. Erhalten von books.google.co.ve


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.