
Eigenschaften und Verwendungen von Jodsäure (HIO2)

Das Jodsäure Es ist eine chemische Verbindung der Formel HIO2. Diese Säure sowie ihre Salze (bekannt als Iodite) sind äußerst instabile Verbindungen, die beobachtet, aber nie isoliert wurden.
Es ist eine schwache Säure, was bedeutet, dass sie nicht vollständig dissoziiert. Im Anion befindet sich Jod in der Oxidationsstufe III und hat eine Struktur analog zu Chlorsäure oder Bromsäure, wie in Abbildung 1 dargestellt.
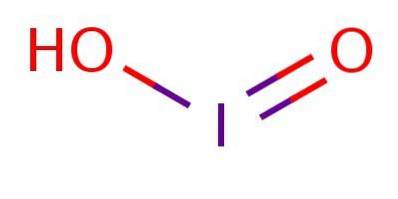
Obwohl die Verbindung instabil ist, wurden Jodsäure und ihre Joditsalze als Zwischenprodukte bei der Umwandlung zwischen Jodiden nachgewiesen (I.-) und Jodate (IO3-).
Seine Instabilität beruht auf einer Dismutationsreaktion (oder einem Missverhältnis) zur Bildung von Hypoiodoid- und Iodsäure, die auf folgende Weise analog zu Chlor- und Bromsäure ist:
2HIO2 -> HIO + HIO3
1823 schrieb der Wissenschaftler Luigi Sementini in Neapel einen Brief an E. Daniell, den Sekretär der königlichen Institution in London, in dem er eine Methode zur Gewinnung von Jodsäure erläuterte.
In dem Brief sagte er, dass unter Berücksichtigung der Bildung von salpetriger Säure Salpetersäure mit dem kombiniert wird, was er salpetriges Gas (möglicherweise N) nenntzweiO) Iodsäure könnte auf die gleiche Weise gebildet werden, indem Iodsäure mit Iodoxid umgesetzt wird, einer Verbindung, die er entdeckt hatte.
Dabei erhielt er eine gelblich-bernsteinfarbene Flüssigkeit, die bei Kontakt mit der Atmosphäre ihre Farbe verlor (Sir David Brewster, 1902)..
Später entdeckte der Wissenschaftler M. Wöhler, dass Sementinis Säure eine Mischung aus Jodchlorid und molekularem Jod ist, da das in der Reaktion verwendete Jodoxid mit Kaliumchlorat hergestellt wurde (Brande, 1828)..
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften
- 2 Verwendungen
- 2.1 Nucleophile Acylierung
- 2.2 Dismutationsreaktionen
- 2.3 Bray-Liebhafsky-Reaktionen
- 3 Referenzen
Physikalische und chemische Eigenschaften
Wie oben erwähnt, ist Iodsäure eine instabile Verbindung, die nicht isoliert wurde. Daher werden ihre physikalischen und chemischen Eigenschaften theoretisch durch rechnerische Berechnungen und Simulationen erhalten (Royal Society of Chemistry, 2015)..
Jodsäure hat ein Molekulargewicht von 175,91 g / mol, eine Dichte von 4,62 g / ml im festen Zustand und einen Schmelzpunkt von 110 Grad Celsius (Jodsäure, 2013-2016)..
Es hat auch eine Wasserlöslichkeit von 269 g / 100 ml bei 20 Grad Celsius (als schwache Säure), einen pKa von 0,75 und eine magnetische Suszeptibilität von –48,0 · 10–6 cm3 / mol (Nationales Zentrum für Biotechnologie) Information, sf).
Da Jodsäure eine instabile Verbindung ist, die nicht isoliert wurde, besteht kein Risiko, damit umzugehen. Durch theoretische Berechnungen wurde festgestellt, dass Jodsäure nicht brennbar ist..
Anwendungen
Nucleophile Acylierung
Iodsäure wird als Nucleophil bei nukleophilen Acylierungsreaktionen verwendet. Das Beispiel wird mit der Acylierung von Trifluoracetylen wie 2,2,2-Trifluoracetylbromid, 2,2,2-Trifluoracetylchlorid, 2,2,2-Trifluoracetylfluorid und 2,2,2-Trifluoracetyliodid unter Bildung des Iodosyls angegeben 2,2,2-Trifluoracetat wie in Abbildung 2.1, 2.2, 2.3 bzw. 2.4 dargestellt.

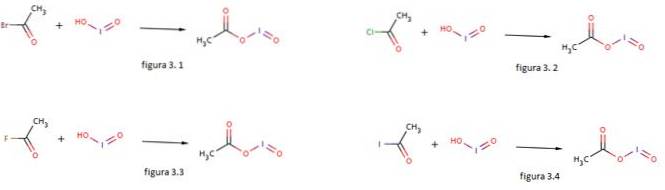
Iodsäure wird auch als Nucleophil zur Bildung von Iodosylacetat verwendet, indem es mit Acetylbromid, Acetylchlorid, Acetylfluorid und Acetyliodid umgesetzt wird, wie in den Abbildungen 3.1, 3.2, 3.3 bzw. 3.4 gezeigt (GNU Free Documentation, sf).
Dismutationsreaktionen
Dismutations- oder Disproportionierungsreaktionen sind eine Art von Oxidreduktionsreaktion, bei der die oxidierte Substanz dieselbe ist, die reduziert wird.
Im Fall von Halogenen können, da sie Oxidationsstufen von -1, 1, 3, 5 und 7 aufweisen, abhängig von den verwendeten Bedingungen unterschiedliche Produkte von Dismutationsreaktionen erhalten werden..
Im Fall von Iodsäure das Beispiel, wie es unter Bildung von Hypoiodinsäure und Iodsäure der Form reagiert.
2HIO2 -> HIO + HIO3
Jüngste Studien haben die Dismutationsreaktion von Jodsäure durch Messung der Protonenkonzentrationen (H) analysiert+), Iodat (IO3-) und das saure Hypoioditkation (H.zweiIO+) um den Mechanismus der Jodsäuredismutation besser zu verstehen (Smiljana Marković, 2015).
Es wurde eine Lösung hergestellt, die die Zwischenspezies I enthielt3+. Eine Mischung von Iod (I) - und Iod (III) -Spezies wurde durch Auflösen von Iod (I) hergestelltzwei) und Kaliumiodat (KIO3) im Verhältnis 1: 5 in konzentrierter Schwefelsäure (96%). In dieser Lösung läuft eine komplexe Reaktion ab, die durch die Reaktion beschrieben werden kann:
ichzwei + 3IO3- + 8H+ -> 5IO+ + H.zweiODER
Art I.3+ Sie sind nur in Gegenwart von zugesetztem überschüssigem Iodat stabil. Jod verhindert die Bildung von I.3+. Das IO-Ion+ Erhalten in Form von Jodsulfat (IO) zweiSW4) zersetzt sich schnell in saurer wässriger Lösung und bildet I.3+, dargestellt als saures HIOzwei oder die ionische Spezies IO3-. Anschließend wurde eine spektroskopische Analyse durchgeführt, um den Wert der Konzentrationen der interessierenden Ionen zu bestimmen..
Dies stellte ein Verfahren zur Bewertung der Pseudo-Gleichgewichtskonzentrationen von Wasserstoff-, Iodat- und H-Ionen vor.zweiICH HÖRTE+, Kinetische und katalytische Spezies, die für den Prozess der Disproportionierung von Jodsäure, HIO, wichtig sindzwei.
Bray-Liebhafsky-Reaktionen
Eine chemische Uhr- oder Oszillationsreaktion ist eine komplexe Mischung reagierender chemischer Verbindungen, bei der sich die Konzentration einer oder mehrerer Komponenten periodisch ändert oder wenn plötzliche Änderungen der Eigenschaften nach einer vorhersagbaren Induktionszeit auftreten.
Sie sind eine Klasse von Reaktionen, die als Beispiel für eine Nichtgleichgewichtsthermodynamik dienen und zur Etablierung eines nichtlinearen Oszillators führen. Sie sind theoretisch wichtig, weil sie zeigen, dass chemische Reaktionen nicht vom thermodynamischen Gleichgewichtsverhalten dominiert werden müssen..
Die Bray-Liebhafsky-Reaktion ist eine chemische Uhr, die erstmals 1921 von William C. Bray beschrieben wurde und die erste Oszillationsreaktion in einer gerührten homogenen Lösung ist..
Jodsäure wird experimentell verwendet, um diese Art von Reaktion zu untersuchen, wenn sie mit Wasserstoffperoxid oxidiert wird, wobei eine bessere Übereinstimmung zwischen dem theoretischen Modell und experimentellen Beobachtungen gefunden wird (Ljiljana Kolar-Anić, 1992)..
Verweise
- Brande, W. T. (1828). Ein Handbuch der Chemie auf der Grundlage von Professor Brande. Boston: Universität von Harvard.
- GNU Kostenlose Dokumentation. (s.f.). Jodsäure. Von chemsink.com abgerufen: chemsink.com
- Jodsäure. (2013-2016). Von molbase.com abgerufen: molbase.com
- Ljiljana Kolar-Anić, G. S. (1992). Mechanismus der Bray-Liebhafsky-Reaktion: Wirkung der Oxidation von Jodsäure durch Wasserstoffperoxid. Chem. Soc., Faraday Trans 1992, 88, 2343-2349. http://pubs.rsc.org/en/content/articlelanding/1992/ft/ft9928802343#!divAbstract
- Nationales Zentrum für Informationen zur Biotechnologie. (n.d.). PubChem Compound Database; CID = 166623. Abgerufen von pubchem.com:pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Jodsäure ChemSpider ID145806. Von ChemSpider abgerufen: chemspider.com
- Sir David Brewster, R. T. (1902). Das London and Edinburgh Philosophical Magazine und das Journal of Science. London: Universität von London.
- Smiljana Marković, R. K. (2015). Disproportionierungsreaktion von Jodsäure, HOIO. Bestimmung der Konzentrationen der relevanten Ionenspezies H +, H2OI + und IO3 -.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.