
Eigenschaften, Risiken und Verwendungen von Perbromsäure (HBrO4)

Das Perbromsäure oder Tetraoxobromsäure ist eine anorganische Verbindung der Formel HBrO4. Seine Struktur ist in Abbildung 1 dargestellt (EMBL-EBI, 2007). Es ist eine Oxidsäurebromsäure, wo sie die Oxidationsstufe 7 aufweist+.
Es ist instabil und kann nicht durch Verdrängung von Chlor aus Perchlorsäure gebildet werden, wenn Perbromsäure hergestellt wird; kann nur durch Protonierung des Perbromat-Ions erfolgen.
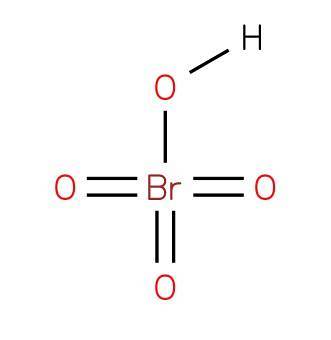
Perbromsäure ist eine starke Säure und ein starkes Oxidationsmittel. Es ist die am wenigsten stabile der Halogenoxacide (VII). Zersetzt sich schnell zu Bromsäure und Sauerstoff und setzt giftige braune Bromdämpfe frei.
Seine konjugierte Base ist das Perbromat, das im Gegensatz zu Perchloraten durch Elektrolyse nicht zugänglich ist. Es entsteht durch Reaktion von Bromat mit Ozon oder wenn Perbromsäure mit Basen reagiert (Ropp, 2013). Es wurde eine neue Synthese von Perbromaten entwickelt, die aus der Oxidation von Bromat mit Fluor in alkalischer Lösung besteht.
Bruder3- + F.zwei + H.zweiO → BrO4- + HF
Es wurde durch den Zerfall einer radioaktiven Selenatprobe (SeO) entdeckt4-). Die Verbindung wird auch hergestellt, indem Bromatkristalle γ-Strahlung ausgesetzt werden (A. J. Downs, 1973)
Perbromsäure ist eine starke einbasige Säure. Seine wässrigen Lösungen sind bis zu ungefähr 6 M (55% HBrO 4) stabil, zersetzen sich jedoch bei höheren Konzentrationen (Appelman, 1969)..
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften
- 2 Reaktivität und Gefahren
- 3 Verwendungen
- 4 Referenzen
Physikalische und chemische Eigenschaften
Perbromsäure existiert nur in Lösung. Es ist eine farblose Flüssigkeit ohne charakteristisches Aroma (Nationales Zentrum für Biotechnologie-Informationen, 2017)..
Die Verbindung hat ein Molekulargewicht von 144,908 g / mol. Aufgrund seiner Instabilität wurden seine Eigenschaften durch Berechnungsmethoden berechnet, wobei festgestellt wurde, dass es einen Schmelz- und Siedepunkt von 204,77 ° C bzw. 512,23 ° C aufweist..
Seine Löslichkeit in Wasser, die ebenfalls durch rechnerische Berechnungen erhalten wird, liegt in der Größenordnung von 1 x 106 mg pro Liter bei 25 ° C (Royal Society of Chemistry, 2015). Perbromsäure ist eine starke Säure mit nur einem Proton für jedes siebenwertige Bromatom. In wässriger Lösung werden das Hydroniumion und BrO vollständig dissoziiert4-.
Lösungen mit Konzentrationen von mehr als 6 M (55% w / v) sind an der Luft instabil, es kommt zu einer autokatalytischen Zersetzung der Verbindung, die bei Konzentrationen von 80% vollständig ist. Diese Zersetzungsreaktion wird auch durch Metalle wie Ce katalysiert4+ und Ag+ (Egon Wiberg, 2001).
Reaktivität und Gefahren
Perbromsäure ist eine instabile Verbindung, hat jedoch im isolierten Zustand starke Säureeigenschaften. Es ist äußerst gefährlich bei Hautkontakt (ätzend und reizend), bei Augenkontakt (reizend) und bei Verschlucken. Auch beim Einatmen sehr gefährlich.
Schwere Überbelichtung kann zu Lungenschäden, Erstickung, Bewusstlosigkeit oder zum Tod führen. Eine längere Exposition kann zu Hautverbrennungen und Geschwüren führen. Eine Überbelichtung durch Einatmen kann zu Reizungen der Atemwege führen..
Eine Entzündung des Auges ist durch Rötung, Bewässerung und Juckreiz gekennzeichnet. Eine Entzündung der Haut ist durch Juckreiz, Peeling, Rötung und gelegentliche Blasenbildung gekennzeichnet.
Die Substanz ist giftig für Nieren, Lunge und Schleimhäute. Wiederholter oder längerer Kontakt mit dem Stoff kann diese Organe schädigen..
Überprüfen Sie bei Kontakt mit den Augen, ob Sie Kontaktlinsen tragen, und entfernen Sie diese sofort. Die Augen sollten mindestens 15 Minuten lang mit fließendem Wasser gespült werden, wobei die Augenlider offen bleiben sollten. Kaltes Wasser kann verwendet werden. Augensalbe sollte nicht verwendet werden.
Wenn die Chemikalie mit Kleidung in Kontakt kommt, entfernen Sie sie so schnell wie möglich, um Ihre eigenen Hände und Ihren Körper zu schützen. Stellen Sie das Opfer unter eine Sicherheitsdusche.
Wenn sich die Chemikalie auf der exponierten Haut des Opfers ansammelt, z. B. auf den Händen, wird die kontaminierte Haut vorsichtig und sorgfältig mit fließendem Wasser und nicht abrasiver Seife gewaschen..
Die Säure kann auch mit verdünntem Natriumhydroxid oder einer schwachen Base wie Backpulver neutralisiert werden. Bei anhaltender Reizung einen Arzt aufsuchen. Waschen Sie die kontaminierte Kleidung, bevor Sie sie erneut verwenden.
Bei starkem Hautkontakt sollte diese mit einer Desinfektionsseife gewaschen und die kontaminierte Haut mit einer antibakteriellen Creme abgedeckt werden..
Im Falle einer Inhalation sollte das Opfer in einem gut belüfteten Bereich ruhen dürfen. Wenn die Inhalation schwerwiegend ist, sollte das Opfer so bald wie möglich an einen sicheren Ort evakuiert werden..
Lösen Sie enge Kleidung wie Hemdkragen, Gürtel oder Krawatte. Wenn das Opfer Schwierigkeiten beim Atmen hat, sollte Sauerstoff verabreicht werden. Wenn das Opfer nicht atmet, wird eine Mund-zu-Mund-Beatmung durchgeführt.
Berücksichtigen Sie immer, dass es für die Person, die Hilfe bei der Mund-zu-Mund-Beatmung leistet, gefährlich sein kann, wenn das eingeatmete Material giftig, infektiös oder ätzend ist.
Bei Verschlucken kein Erbrechen herbeiführen. Lösen Sie enge Kleidung wie Hemdkragen, Gürtel oder Krawatten. Wenn das Opfer nicht atmet, führen Sie eine Mund-zu-Mund-Beatmung durch. Suchen Sie in jedem Fall sofort einen Arzt auf..
Anwendungen
Perbromsäure wird hauptsächlich als Reduktionsmittel im Labor verwendet. Verdünnte Perbromsäurelösungen sind trotz ihres großen REDOX-Potentials (+1,76 Volt) langsame Oxidationsmittel, jedoch ein besseres Oxidationsmittel als Perchlorsäure.
Perbromsäure kann Bromid- und Iodidionen langsam oxidieren. In Lösungen mit einer Konzentration von 12 Mol kann es das Chloridion schnell oxidieren und in Gegenwart von Salpetersäure explodieren. Lösungen mit einer Konzentration von 3 Mol Perbromsäure können Edelstahl leicht oxidieren.
Bei einer Temperatur von 100 ° C können 6 molare Lösungen von Perbromsäure das Manganion (Mnzwei+) zu permanganieren (MnO4-). Die Reduktion der Verbindung zu Brom kann mit Zinnchlorid (SnO) erreicht werdenzwei).
Die andere Verwendung von Perbromsäure ist die Synthese von Perbromatsalzen wie Natriumperbromat oder Kaliumperbromat..
Letzteres ist eine ziemlich stabile Verbindung, die Temperaturen von 274 ° C widersteht. Bei höheren Temperaturen wird es im Gegensatz zu Perchlorat, das bei hohen Temperaturen Sauerstoff und Kaliumchlorid erzeugt, zu Kaliumbromat reduziert.
Verweise
- J. Downs, C. J. (1973). Die Chemie von Chlor, Brom, Jod und Astatin. Oxford: Pergamonpresse LTD.
- Appelman, E. H. (1969). Perbromsäure und Perbromate: Synthese und einige Eigenschaften. Anorganische Chemie 8 (2) , 223-227. Von researchgate.net wiederhergestellt.
- Egon Wiberg, N. W. (2001). Anorganische Chemie. New York: Akademische Presse.
- EMBL-EBI. (2007, 28. Oktober). Perbromsäure. Von ebi.ac.uk wiederhergestellt.
- Nationales Zentrum für Informationen zur Biotechnologie. (2017, 30. April). PubChem Compound Database; CID = 192513. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Ropp, R. C. (2013). Enzyklopädie der Erdalkaliverbindungen. Oxford: Elsevier.
- Royal Society of Chemistry. (2015). Perbromsäure. Von chemspider.com wiederhergestellt.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.