
Fumarsäurestruktur, Eigenschaften, Verwendungen und Risiken

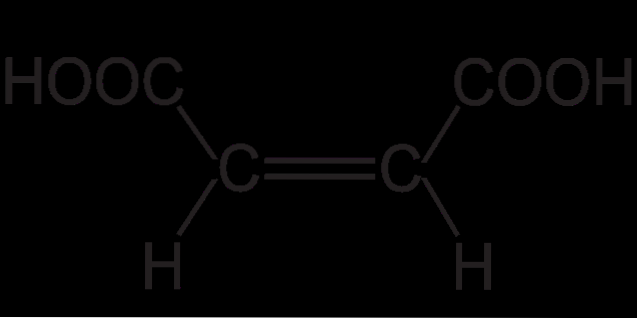
Das Fumarsäure oder trans-Butendisäure ist eine schwache Dicarbonsäure, die in den Krebszyklus (oder Tricarbonsäurezyklus) und in den Harnstoffzyklus eingreift. Seine Molekülstruktur ist HOOCCH = CHCOOH, dessen kondensierte Molekülformel C ist4H.4ODER4. Die Salze und Ester der Fumarsäure werden Fumarate genannt.
Es wird im Krebszyklus aus Succinat hergestellt, das durch die Wirkung des Enzyms Succinatdehydrogenase unter Verwendung von FAD (Flavin Adenil Dinucleotide) als Coenzym zu Fumarat oxidiert wird. Während FAD auf FADH reduziert wirdzwei. Anschließend wird das Fumarat durch die Wirkung des Enzyms Fumarase zu L-Malat hydratisiert.
Im Harnstoffzyklus wird Arginosuccinat durch die Wirkung des Enzyms Arginosuccinatlyase in Fumarat umgewandelt. Fumarat wird durch cytosolische Fumarase in Malat umgewandelt.
Fumarsäure kann aus Glukose in einem durch den Pilz Rhizopus nigricans vermittelten Prozess hergestellt werden. Fumarsäure kann auch durch Kalorienisomerisierung von Maleinsäure erhalten werden. Es kann auch durch Oxidation von Furfural mit Natriumchlorat in Gegenwart von Vanadiumpentoxid synthetisiert werden..
Fumarsäure hat viele Verwendungszwecke; als Lebensmittelzusatzstoff, Harzproduktion und bei der Behandlung einiger Krankheiten wie Psoriasis und Multipler Sklerose. Es birgt jedoch leichte Gesundheitsrisiken, die berücksichtigt werden sollten..
Artikelverzeichnis
- 1 Chemische Struktur
- 1.1 Geometrische Isomerie
- 2 Physikalische und chemische Eigenschaften
- 2.1 Summenformel
- 2.2 Molekulargewicht
- 2.3 Aussehen
- 2.4 Geruch
- 2.5 Geschmack
- 2.6 Siedepunkt
- 2.7 Schmelzpunkt
- 2.8 Flammpunkt
- 2.9 Löslichkeit in Wasser
- 2.10 Löslichkeit in anderen Flüssigkeiten
- 2.11 Dichte
- 2.12 Dampfdruck
- 2.13 Stabilität
- 2.14 Selbstentzündung
- 2.15 Verbrennungswärme
- 2,16 pH
- 2.17 Zersetzung
- 3 Verwendungen
- 3.1 In Lebensmitteln
- 3.2 Bei der Herstellung von Harzen
- 3.3 In der Medizin
- 4 Risiken
- 5 Referenzen
Chemische Struktur
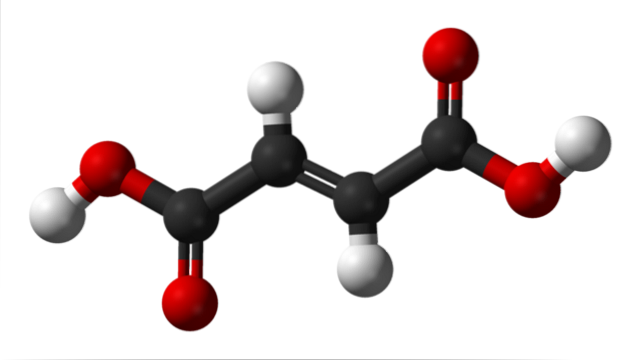
Das obere Bild zeigt die Molekülstruktur von Fumarsäure. Die schwarzen Kugeln entsprechen den Kohlenstoffatomen, aus denen das hydrophobe Gerüst besteht, während die roten Kugeln zu den beiden Carboxylgruppen COOH gehören. Somit sind beide COOH-Gruppen nur durch zwei Kohlenstoffe getrennt, die durch eine Doppelbindung verbunden sind, C = C..
Man kann sagen, dass die Struktur von Fumarsäure eine lineare Geometrie aufweist. Dies liegt daran, dass alle Atome seines Carbonatgerüsts eine sp-Hybridisierung aufweisenzwei und deshalb ruhen sie zusätzlich zu den beiden zentralen Wasserstoffatomen in derselben Ebene (die beiden weißen Kugeln, von denen eine nach oben und die andere nach unten zeigt).
Die einzigen zwei Atome, die aus dieser Ebene herausragen (und mit wenigen steilen Winkeln), sind die beiden sauren Protonen der COOH-Gruppen (die weißen Kugeln an den Seiten). Wenn Fumarsäure vollständig deprotoniert ist, erhält sie zwei negative Ladungen, die an ihren Enden mitschwingen und so zu einem zweibasischen Anion werden..
Geometrische Isomerie
Die Struktur der Fumarsäure zeigt eine trans- (oder E-) Isomerie. Dies liegt in den relativen räumlichen Positionen der Substituenten an der Doppelbindung. Die beiden kleinen Wasserstoffatome zeigen in entgegengesetzte Richtungen, ebenso wie die beiden COOH-Gruppen..
Dies gibt der Fumarsäure ein "zickzackförmiges" Gerüst. Während für sein anderes geometrisches Isomer cis (oder Z), das nichts anderes als Maleinsäure ist, ein gekrümmtes Skelett in Form eines "C" vorliegt. Diese Krümmung ist das Ergebnis des frontalen Treffens der beiden COOH-Gruppen und der beiden H-Gruppen in derselben Ausrichtung:
Physikalische und chemische Eigenschaften
Molekularformel
C.4H.4ODER4.
Molekulargewicht
116,072 g / mol.
Aussehen
Ein farbloser kristalliner Feststoff. Die Kristalle sind nadelförmig monoklin.
Weißes kristallines Pulver oder Granulat.
Geruch
Toilette.
Geschmack
Zitrusfrucht.
Siedepunkt
329 ° F bei einem Druck von 1,7 mmmHg (522 ° C). Sublimiert bei 200 ° C und zersetzt sich bei 287 ° C..
Schmelzpunkt
287 ° C.
Flammpunkt
273ºC (offenes Glas). 230º C (geschlossene Tasse).
Wasserlöslichkeit
7.000 mg / l bei 25 ° C..
Löslichkeit in anderen Flüssigkeiten
-Löslich in Ethanol und in konzentrierter Schwefelsäure. Mit Ethanol kann es Wasserstoffbrückenbindungen bilden, und im Gegensatz zu Wassermolekülen interagieren die von Ethanol mit größerer Affinität mit dem organischen Gerüst seiner Struktur.
-In Ethylester und Aceton schwer löslich.
Dichte
1,635 g / cm3 bei 68ºF 1.635 g / cm3 bei 20ºC.
Dampfdruck
1,54 x 10-4 mmHg bei 25 ° C..
Stabilität
Es ist stabil, obwohl es durch aerobe und anaerobe Mikroorganismen abbaubar ist.
Wenn Fumarsäure in einem geschlossenen Behälter mit Wasser zwischen 150 ° C und 170 ° C erhitzt wird, entsteht DL-Apfelsäure..
Selbstentzündung
375 ° C.
Verbrennungswärme
2.760 cal / g.
pH
3,0-3,2 (0,05% ige Lösung bei 25 ° C). Dieser Wert hängt vom Dissoziationsgrad der beiden Protonen ab, da es sich um eine Dicarbonsäure handelt und daher diprotisch ist..
Zersetzung
Es zersetzt sich beim Erhitzen und erzeugt ein ätzendes Gas. Reagiert heftig mit starken Oxidationsmitteln und erzeugt brennbare und giftige Gase, die Feuer und sogar Explosionen verursachen können.
Bei teilweiser Verbrennung wandelt sich Fumarsäure in das reizende Maleinsäureanhydrid um..
Anwendungen
Im Essen
-Es wird als Säuerungsmittel in Lebensmitteln verwendet und erfüllt eine regulierende Funktion des Säuregehalts. Zu diesem Zweck kann es auch Weinsäure und Zitronensäure ersetzen. Darüber hinaus wird es als Lebensmittelkonservierungsmittel verwendet.
-In der Lebensmittelindustrie wird Fumarsäure als Säuerungsmittel für Erfrischungsgetränke, Weine nach westlicher Art, kalte Getränke, Fruchtsaftkonzentrate, Obstkonserven, Gurken, Eiscreme und Erfrischungsgetränke verwendet..
-Fumarsäure wird in alltäglichen Getränken wie Schokoladenmilch, Eierlikör, Kakao und Kondensmilch verwendet. Fumarsäure wird auch Käse zugesetzt, einschließlich Schmelzkäse und Käseersatz..
-Desserts wie Pudding, aromatisierter Joghurt und Sorbets können Fumarsäure enthalten. Diese Säure kann Eier und Desserts auf Eibasis wie Pudding konservieren..
Zusätzliche Anwendungen in der Lebensmittelindustrie
-Fumarsäure hilft, Lebensmittel zu stabilisieren und zu würzen. Speck und Konserven haben auch diese Verbindung hinzugefügt.
-Die kombinierte Verwendung mit Benzoaten und Borsäure wirkt gegen den Abbau von Fleisch, Fisch und Schalentieren.
-Es hat antioxidative Eigenschaften, weshalb es zur Konservierung von Butter, Käse und Milchpulver verwendet wurde..
-Erleichtert die Handhabung des Mehlteigs und erleichtert das Verarbeiten.
-Es wurde mit Erfolg in der Ernährung von Schweinen im Hinblick auf Gewichtszunahme, Verbesserung der Verdauungsaktivität und Verringerung pathogener Bakterien im Verdauungssystem eingesetzt.
Bei der Herstellung von Harzen
-Fumarsäure wird zur Herstellung von ungesättigten Polyesterharzen verwendet. Dieses Harz weist eine ausgezeichnete Beständigkeit gegen chemische Korrosion und Wärmebeständigkeit auf. Darüber hinaus wird es zur Herstellung von Alkydharzen, Phenolharzen und Elastomeren (Kautschuken) verwendet..
-Fumarsäure / Vinylacetat-Copolymer ist eine hochwertige Form von Klebstoff. Das Copolymer von Fumarsäure mit Styrol ist ein Rohstoff bei der Herstellung von Glasfasern.
-Es wurde zur Herstellung von mehrwertigen Alkoholen und als Beizmittel für Farbstoffe verwendet.
In Behandlung
-Natriumfumarat kann mit Eisensulfat unter Bildung des Eisenfumaratgels reagieren, wodurch das Arzneimittel unter dem Namen Fersamal entsteht. Dies wird auch bei der Behandlung von Anämie bei Kindern angewendet.
-Dimethylfumaratester wurde bei der Behandlung von Multipler Sklerose verwendet, wodurch das Fortschreiten der Behinderung verringert wurde.
-Bei der Behandlung von Psoriasis wurden verschiedene Ester von Fumarsäure verwendet. Fumarsäureverbindungen würden ihre therapeutische Wirkung durch ihre immunmodulatorische und immunsuppressive Fähigkeit ausüben..
-Die Pflanze Fumaria officinalis enthält von Natur aus Fumarsäure und wird seit Jahrzehnten zur Behandlung von Psoriasis eingesetzt.
Bei einem Patienten, der wegen Psoriasis mit Fumarsäure behandelt wurde, wurden jedoch Nierenversagen, Leberfunktionsstörungen, gastrointestinale Effekte und Hitzewallungen beobachtet. Die Störung wurde als akute tubuläre Nekrosie diagnostiziert.
Experimente mit dieser Verbindung
-In einem Experiment am Menschen, dem ein Jahr lang 8 mg Fumarsäure / Tag verabreicht wurden, zeigte keiner der Teilnehmer eine Leberschädigung.
-Fumarsäure wurde verwendet, um Thiocetamid-induzierte Lebertumoren bei Mäusen zu hemmen..
-Es wurde bei Mäusen angewendet, die mit Mitomycin C behandelt wurden. Dieses Medikament verursacht Leberanomalien, die aus verschiedenen zytologischen Veränderungen bestehen, wie perinukleären Unregelmäßigkeiten, Chromatinaggregation und abnormalen zytoplasmatischen Organellen. Auch Fumarsäure reduziert das Auftreten dieser Veränderungen.
-In Experimenten mit Ratten hat Fumarsäure eine Hemmkapazität für die Entwicklung von Papillom der Speiseröhre, zerebralen Gliom und in mesenchymalen Tumoren der Niere gezeigt..
-Es gibt Experimente, die eine entgegengesetzte Wirkung von Fumarsäure in Bezug auf Krebstumoren zeigen. Es wurde kürzlich als Oncometabolit oder endogener Metabolit identifiziert, der Krebs verursachen kann. In Tumoren und in der Flüssigkeit um den Tumor sind hohe Fumarsäurespiegel vorhanden.
Risiken
-Bei Kontakt mit den Augen kann Fumarsäurepulver Reizungen verursachen, die sich in Rötungen, Tränen und Schmerzen äußern.
-Bei Hautkontakt kann es zu Reizungen und Rötungen kommen.
-Einatmen kann die Schleimhaut der Nasenwege, des Kehlkopfes und des Rachens reizen. Es kann auch Husten oder Atemnot verursachen..
-Andererseits zeigt Fumarsäure bei Einnahme keine Toxizität..
Verweise
- Steven A. Hardinger (2017). Illustriertes Glossar der Organischen Chemie: Fumarsäure. Entnommen aus: chem.ucla.edu
- Transmerquim Group. (August 2014). Fumarsäure. [PDF]. Entnommen aus: gtm.net
- Wikipedia. (2018). Fumarsäure. Entnommen aus: en.wikipedia.org/wiki/Fumaric_acid
- PubChem. (2018). Fumarsäure. Entnommen aus: pubchem.ncbi.nlm.nih.gov
- Royal Society of Chemistry. (2015). Fumarsäure. Entnommen aus: chemspider.com
- ChemicalBook. (2017). Fumarsäure. Entnommen aus: Chemicalbook.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.