
Zitronensäurestruktur, Eigenschaften, Herstellung und Verwendung
Das Zitronensäure ist eine organische Verbindung, die aus einer schwachen Säure besteht, deren chemische Formel C ist6H.8ODER7. Wie der Name schon sagt, sind Zitrusfrüchte eine der wichtigsten natürlichen Quellen, und sie stammen auch vom lateinischen Wort "Zitrusfrüchte" ab, was "bitter" bedeutet..
Es ist nicht nur eine schwache Säure, es ist auch polyprotisch; das heißt, es kann mehr als ein Wasserstoffion H freisetzen+. Es ist genau eine Tricarbonsäure, daher hat es drei -COOH-Gruppen, die H-Ionen abgeben+. Jeder von ihnen hat seine eigene Tendenz, sich in seine Umgebung zu befreien..

Daher ist seine Strukturformel besser als C definiert3H.5O (COOH)3. Dies ist der chemische Grund für seinen Beitrag zum charakteristischen Geschmack von beispielsweise Orangensegmenten. Obwohl es aus den Früchten stammt, wurden seine Kristalle erst 1784 aus einem Zitronensaft in England isoliert.
Es macht etwa 8 Massen-% einiger Zitrusfrüchte wie Zitronen und Grapefruits aus. Es kann auch in Paprika, Tomaten, Artischocken und anderen Lebensmitteln gefunden werden..
Artikelverzeichnis
- 1 Wo befindet sich Zitronensäure??
- 2 Struktur der Zitronensäure
- 2.1 Intermolekulare Wechselwirkungen
- 3 Physikalische und chemische Eigenschaften
- 3.1 Molekulargewicht
- 3.2 Aussehen
- 3.3 Geschmack
- 3.4 Schmelzpunkt
- 3.5 Siedepunkt
- 3.6 Dichte
- 3.7 Löslichkeit
- 3,8 pKa
- 3.9 Zersetzung
- 3.10 Derivate
- 4 Produktion
- 4.1 Chemische oder synthetische Synthese
- 4.2 Natürlich
- 4.3 Durch Fermentation
- 5 Verwendungen
- 5.1 In der Lebensmittelindustrie
- 5.2 In der pharmazeutischen Industrie
- 5.3 In der Kosmetikindustrie und allgemein
- 6 Toxizität
- 7 Referenzen
Wo ist Zitronensäure gefunden?
Es kommt in geringen Anteilen in allen Pflanzen und Tieren vor und ist ein Metabolit von Lebewesen. Es ist eine Zwischenverbindung des aeroben Metabolismus, die im Tricarbonsäurezyklus oder Zitronensäurezyklus vorhanden ist. In der Biologie oder Biochemie wird dieser Zyklus auch als Krebszyklus bezeichnet, ein Amphibol-Stoffwechselweg.
Diese Säure kommt nicht nur auf natürliche Weise in Pflanzen und Tieren vor, sondern wird auch in großem Maßstab durch Fermentation synthetisch gewonnen..
Es ist in der Lebensmittelindustrie, in Pharmazeutika und Chemikalien weit verbreitet und verhält sich wie ein natürliches Konservierungsmittel. Es und seine Derivate werden massiv auf industrieller Ebene hergestellt, um feste und flüssige Lebensmittel zu würzen.
Findet Verwendung als Zusatz in verschiedenen Hautschönheitsprodukten; Es wird auch als Chelatbildner, Säuerungsmittel und Antioxidans verwendet. Die Verwendung in hohen oder reinen Konzentrationen wird jedoch nicht empfohlen. da es Reizungen, Allergien und sogar Krebs verursachen kann.
Zitronensäurestruktur
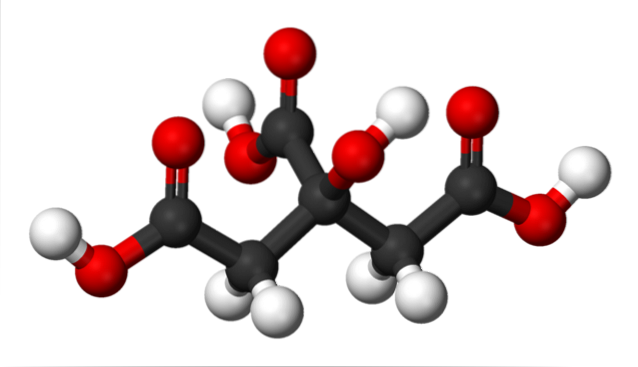
Im oberen Bild ist die Struktur der Zitronensäure mit einem Kugel- und Balkenmodell dargestellt. Wenn Sie genau hinschauen, finden Sie das Skelett von nur drei Kohlenstoffen: Propan.
Das Kohlenstoffatom im Zentrum ist an eine Gruppe -OH gebunden, die in Gegenwart von Carboxylgruppen -COOH die Terminologie "Hydroxy" annimmt. Die drei -COOH-Gruppen sind am linken und rechten Ende sowie am oberen Rand der Struktur leicht zu erkennen. Von diesen werden die H freigesetzt+.
Andererseits kann die -OH-Gruppe auch ein saures Proton verlieren, so dass insgesamt keine drei H vorhanden wären+, aber vier. Letzteres erfordert jedoch eine beträchtlich starke Base, und folglich ist sein Beitrag zur charakteristischen Acidität von Zitronensäure im Vergleich zu dem der -COOH-Gruppen viel geringer..
Aus alledem folgt, dass Zitronensäure auch als 2-Hydroxy-1,2,3-tricarbonspropan bezeichnet werden kann.
In C-2 befindet sich eine -OH-Gruppe, die an die -COOH-Gruppe angrenzt (siehe obere Mitte der Struktur). Aus diesem Grund fällt Zitronensäure auch unter die Klassifikation der Alpha-Hydroxysäuren; wobei alpha "benachbart" bedeutet, dh es gibt nur ein Kohlenstoffatom, das -COOH und -OH trennt.
Intermolekulare Wechselwirkungen
Wie zu sehen ist, hat die Zitronensäurestruktur eine hohe Fähigkeit, Wasserstoffbrücken zu spenden und zu akzeptieren. Dies macht es sehr verwandt mit Wasser und auch der Grund, warum es sehr leicht einen monohydratfesten, rhomboedrischen Kristall bildet..
Diese Wasserstoffbrückenbindungen sind auch für die Bildung der farblosen monoklinen Zitronensäurekristalle verantwortlich. Wasserfreie Kristalle (ohne Wasser) können nach Bildung in heißem Wasser erhalten werden, gefolgt von vollständiger Verdampfung..
Physikalische und chemische Eigenschaften
Molekulargewicht
210,14 g / mol.
Aussehen
Farblose und geruchlose Säurekristalle.
Geschmack
Sauer und bitter.
Schmelzpunkt
153 ° C..
Siedepunkt
175 ° C..
Dichte
1,66 g / ml.
Löslichkeit
Es ist eine in Wasser gut lösliche Verbindung. Es ist auch in anderen polaren Lösungsmitteln wie Ethanol und Ethylacetat sehr gut löslich. In unpolaren und aromatischen Lösungsmitteln wie Benzol, Toluol, Chloroform und Xylol ist es unlöslich.
pKa
-3.1
-4.7
-6.4
Dies sind die pKa-Werte für jede der drei -COOH-Gruppen. Es ist zu beachten, dass das dritte pKa (6,4) kaum leicht sauer ist, so dass es wenig dissoziiert.
Zersetzung
Bei extremen Temperaturen oder über 175 ° C zersetzt es sich unter Freisetzung von COzwei und Wasser. Daher erreicht die Flüssigkeit kein signifikantes Kochen, da sie sich zuerst zersetzt..
Derivate
Wie du verlierst H.+, andere Kationen nehmen ihren Platz ein, aber auf ionische Weise; das heißt, die negativen Ladungen der -COO-Gruppen- ziehen andere Arten positiver Ladungen an, wie z. B. Na+. Je deprotonierter die Zitronensäure ist, desto mehr Kationen haben ihre als Citrat bezeichneten Derivate.
Ein Beispiel ist Natriumcitrat, das als Gerinnungsmittel eine sehr nützliche chelatisierende Wirkung hat. Diese Citrat können daher mit Metallen in Lösung Komplexe bilden..
Auf der anderen Seite ist die H.+ der -COOH-Gruppen können sogar durch andere kovalent verknüpfte Spezies wie R-Seitenketten substituiert werden, wodurch Citratester entstehen: C.3H.5ODER (COOR)3.
Die Diversität ist sehr groß, da nicht unbedingt alle H durch R, sondern auch durch Kationen ersetzt werden müssen.
Produktion
Zitronensäure kann auf natürliche und kommerzielle Weise durch Fermentation von Kohlenhydraten hergestellt werden. Die Herstellung wurde auch synthetisch durch chemische Prozesse durchgeführt, die heute nicht sehr aktuell sind..
Für seine Herstellung wurden mehrere biotechnologische Verfahren eingesetzt, da diese Verbindung weltweit sehr gefragt ist.
Chemische oder synthetische Synthese
-Einer dieser chemischen Synthesevorgänge wird unter Hochdruckbedingungen aus Calciumsalzen von Isocitrat durchgeführt. Der aus Zitrusfrüchten extrahierte Saft wird mit Calciumhydroxid behandelt und Calciumcitrat wird erhalten..
Dieses Salz wird dann extrahiert und mit einer verdünnten Schwefelsäurelösung umgesetzt, deren Funktion darin besteht, das Citrat in seine ursprüngliche Säureform zu protonieren..
-Zitronensäure wurde auch aus Glycerin synthetisiert, indem seine Komponenten durch eine Carboxylgruppe ersetzt wurden. Wie bereits erwähnt, sind diese Verfahren für die Produktion von Zitronensäure in großem Maßstab nicht optimal..
natürlich
Zitronensäure kommt im Körper auf natürliche Weise im aeroben Stoffwechsel vor: im Tricarbonsäurezyklus. Wenn Acetyl-Coenzym A (Acetyl-CoA) in den Kreislauf eintritt, bindet es an Oxalessigsäure und bildet Zitronensäure..
Und woher kommt Acetyl-CoA??
Bei den Reaktionen des Katabolismus von Fettsäuren treten unter anderem Kohlenhydrate in Gegenwart von O aufzwei Acetyl-CoA wird hergestellt. Dies entsteht als Produkt der Beta-Oxidation von Fettsäuren, der Umwandlung von Pyruvat, das bei der Glykolyse erzeugt wird.
Im Krebszyklus oder Zitronensäurezyklus gebildete Zitronensäure wird zu Alpha-Ketoglutarsäure oxidiert. Dieser Prozess stellt einen amphibolischen Oxidations-Reduktions-Weg dar, aus dem Äquivalente erzeugt werden, die dann Energie oder ATP produzieren..
Die kommerzielle Herstellung von Zitronensäure als Zwischenprodukt des aeroben Stoffwechsels war jedoch auch nicht rentabel oder zufriedenstellend. Nur unter Bedingungen eines organischen Ungleichgewichts kann die Konzentration dieses Metaboliten erhöht werden, was für Mikroorganismen nicht lebensfähig ist.
Durch Gärung
Mikroorganismen wie Pilze und Bakterien produzieren Zitronensäure durch Fermentation von Zucker.
Die Herstellung von Zitronensäure aus der mikrobiellen Fermentation hat zu besseren Ergebnissen geführt als die Herstellung durch chemische Synthese. Im Zusammenhang mit dieser kommerziellen Massenproduktionsmethode wurden Forschungslinien entwickelt, die große wirtschaftliche Vorteile bieten..
Die Anbautechniken auf industrieller Ebene haben sich im Laufe der Zeit verändert. Es wurden Kulturen für die Oberflächen- und Unterwasserfermentation verwendet. Untergetauchte Kulturen sind solche, bei denen Mikroorganismen aus Substraten, die in flüssigen Medien enthalten sind, Fermentation erzeugen.
Die Produktionsprozesse von Zitronensäure durch untergetauchte Fermentation, die unter anaeroben Bedingungen stattfinden, waren optimal..
Einige Pilze mögen Aspergillus niger, Saccahromicopsis sp, und Bakterien mögen Bacillus licheniformis, haben erlaubt, mit dieser Art der Fermentation eine hohe Ausbeute zu erzielen.
Pilze mögen Aspergillus niger oder Candida sp, Sie produzieren Zitronensäure durch die Fermentation von Melasse und Stärke. Unter anderem werden auch Rohr-, Mais- und Rübenzucker als Fermentationssubstrate verwendet..
Anwendungen
Zitronensäure wird in der Lebensmittelindustrie häufig zur Herstellung von pharmazeutischen Produkten verwendet. Es wird auch in unzähligen chemischen und biotechnologischen Prozessen eingesetzt..
In der Lebensmittelindustrie
-Zitronensäure wird hauptsächlich in der Lebensmittelindustrie verwendet, da sie ihnen einen angenehmen sauren Geschmack verleiht. Es ist sehr wasserlöslich und wird daher Getränken, Süßigkeiten, Bonbons, Gelees und gefrorenen Früchten zugesetzt. Es wird auch zur Herstellung von Weinen, Bieren und anderen Getränken verwendet..
-Zusätzlich zur Zugabe eines sauren Geschmacks inaktiviert es Spurenelemente, die Ascorbinsäure oder Vitamin C schützen. Es wirkt auch als Emulgator in Eiscreme und Käse. Trägt zur Inaktivierung oxidativer Enzyme bei, indem der pH-Wert von Lebensmitteln gesenkt wird.
-Erhöht die Wirksamkeit von Konservierungsstoffen, die Lebensmitteln zugesetzt werden. Durch die Bereitstellung eines relativ niedrigen pH-Werts wird die Wahrscheinlichkeit verringert, dass Mikroorganismen in verarbeiteten Lebensmitteln überleben, wodurch ihre Haltbarkeit erhöht wird..
-In Fetten und Ölen wird Zitronensäure verwendet, um die synergistische antioxidative Wirkung (aller Fettbestandteile) dieser Art von Nährstoffen zu verstärken..
In der pharmazeutischen Industrie
-Zitronensäure wird auch häufig als Hilfsstoff in der pharmazeutischen Industrie verwendet, um den Geschmack und die Auflösung von Arzneimitteln zu verbessern..
-In Kombination mit Bicarbonat wird Zitronensäure pulverförmigen Produkten und Tablettenprodukten auf eine Weise zugesetzt, die als Brausetabletten wirkt.
-Die Salze der Zitronensäure ermöglichen ihre Verwendung als Antikoagulans, da es die Fähigkeit besitzt, Calcium zu chelatisieren. Zitronensäure wird in Mineralstoffzusätzen wie Citrat-Salzen verabreicht.
-Durch die Ansäuerung des Mediums des Absorptionsprozesses im Darm optimiert Zitronensäure die Aufnahme von Vitaminen und einigen Arzneimitteln. Seine wasserfreie Form wird als Zusatz zu anderen Arzneimitteln bei der Auflösung von Steinen verabreicht.
-Es wird auch als adstringierendes Säuerungsmittel als Mittel verwendet, das die Auflösung der Wirkstoffe verschiedener pharmazeutischer Produkte erleichtert..
In der Kosmetikindustrie und allgemein
-Zitronensäure wird als Chelatbildner für Metallionen in Toilettenartikeln und Kosmetika verwendet..
-Es wird im Allgemeinen zum Reinigen und Polieren von Metallen verwendet, wobei das sie bedeckende Oxid entfernt wird.
-In geringen Konzentrationen dient es als Zusatz zu ökologischen und umweltschonenden ökologischen Reinigungsprodukten..
-Es hat eine Vielzahl von Verwendungsmöglichkeiten: Es wird in fotografischen Reagenzien, Textilien und beim Ledergerben verwendet.
-Fügt Druckfarben hinzu.
Toxizität
Berichte über seine Toxizität sind unter anderem mit einer hohen Konzentration an Zitronensäure, Expositionszeit und Verunreinigungen verbunden..
Verdünnte Zitronensäurelösungen stellen kein Risiko oder eine Gefahr für die Gesundheit dar. Reine oder konzentrierte Zitronensäure stellt jedoch ein Sicherheitsrisiko dar und sollte daher nicht konsumiert werden..
Rein oder konzentriert, ist es ätzend und reizend bei Kontakt mit der Haut und den Schleimhäuten von Augen, Nase und Rachen. Kann beim Verschlucken allergische Hautreaktionen und akute Toxizität verursachen..
Das Einatmen von reinem Zitronensäurestaub kann auch die Schleimhaut der Atemwege beeinträchtigen. Einatmen kann Atemnot, Allergien, Sensibilisierung der Atemschleimhaut und sogar Asthma auslösen.
Reproduktionstoxische Wirkungen werden berichtet. Zitronensäure kann genetische Defekte verursachen und Mutationen in Keimzellen verursachen.
Und schließlich wird es als gefährlich oder giftig für den aquatischen Lebensraum angesehen, und im Allgemeinen ist konzentrierte Zitronensäure für Metalle ätzend..
Verweise
- BellChem (21. April 2015). Die Verwendung von Zitronensäure in der Lebensmittelindustrie. Wiederhergestellt von: bellchem.com
- Vandenberghe, Luciana P. S., Soccol, Carlos R., Pandey, Ashok & Lebeault, Jean-Michel. (1999). Mikrobielle Produktion von Zitronensäure. Brasilianisches Archiv für Biologie und Technologie, 42 (3), 263-276. dx.doi.org/10.1590/S1516-89131999000300001
- PubChem. (2018). Zitronensäure. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Zitronensäure. Wiederhergestellt von: en.wikipedia.org
- Whitten, K., Davis, R., Peck M. und Stanley, G. (2008). Chemie. (8ava. ed). CENGAGE Lernen: Mexiko.
- Berovic, M. und Legisa, M. (2007). Zitronensäureproduktion. Biotechology Jahresrückblick. Wiederhergestellt von: researchgate.net



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.