
Formel, Eigenschaften und Verwendungen von Chlorsäure (HClO2)

Das Chlorsäure ist eine anorganische Verbindung mit der Formel HClOzwei. Diese Säure ist eine der Oxidsäuren von Chlor, wo sie sich in Oxidationsstufe 3 befindet+. Obwohl es schwierig ist, die Säure in ihrer reinen Substanz zu erhalten, ist die von diesen Säuren abgeleitete konjugierte Base, das Chlorition, stabil..
Ein Beispiel für ein Salz dieses Anions ist das bekannte Natriumchlorit. Dieses und verwandte Salze werden manchmal bei der Herstellung von Chlordioxid verwendet..
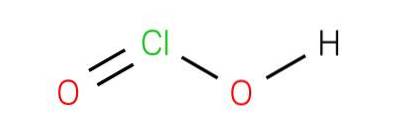
Chlorsäure ist eine schwache Säure. Die Reinsubstanz ist instabil, unverhältnismäßig zu Hypochlorsäure (Cl + 1-Oxidationsstufe) und Chlorsäure (Cl + 5-Oxidationsstufe):
2HClOzwei → HClO + HClO3
Chlorsäure wird zusammen mit Chlorsäure bei der Zersetzung der wässrigen Chlordioxidlösung erhalten.
Die Chlorsäurelösung wurde zum ersten Mal durch Reduzieren von Chlorsäure mit Weinsäure erhalten (A. J. Downs, 1973). Das Hauptverfahren zum Erhalten dieser Säure besteht jedoch darin, eine Suspension von Bariumchlorid mit Schwefelsäure zu behandeln:
Ba (ClOzwei)zwei + H.zweiSW4 → BaSO4 + 2HClOzwei
Chlorsäure ist ein starkes Oxidationsmittel, obwohl ihre Neigung zur Dismutation oder zum Missverhältnis seinem Oxidationspotential entgegenwirkt..
Chlor ist das einzige Halogen, das eine isolierbare Säure der Formel HXO bildetzwei. Weder Brom- noch Jodsäure wurden isoliert. Einige Salze der Bromsäure, Bromite, sind bekannt, aber außer als Zwischenprodukte bei Reaktionen gibt es keine Ioditsalze..
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften
- 2 Reaktivität und Gefahren
- 3 Verwendungen
- 4 Referenzen
Physikalische und chemische Eigenschaften
Wenn Chlorsäure isoliert wird, ist sie eine farblose Flüssigkeit ohne charakteristisches Aroma (Nationales Zentrum für Biotechnologie-Informationen, 2017)..
Die Verbindung hat ein Molekulargewicht von 68,456 g / mol. Es hat einen Siedepunkt (berechnet) von 502,07 ° C und eine Wasserlöslichkeit (berechnet) von 1 × 106 mg / l (Royal Society of Chemistry, 2015).
HClOzwei es ist aufgrund der Dismutations- (oder Disproportionierungs-) Reaktion instabil, Chlor- und Hypochlorsäure (C. C. Hong, 1968) ähnlich der der analogen Brom- und Iodsäuren zu erzeugen:
2HClOzwei → HClO + HClO3
Chlorsäure wird als schwache Säure angesehen, obwohl ihre Dissoziationskonstante in der Größenordnung von 1 × 10 liegt-zwei das macht es nicht so schwach wie andere Säuren mit einem pKa von 1,96.
Reaktivität und Gefahren
Chlorsäure ist eine instabile Verbindung und ein starkes Oxidationsmittel, das mit Reduktionsmitteln und Laugen nicht kompatibel ist..
Chlorsäure reizt bei Kontakt mit Haut und Augen und ist bei Verschlucken und Einatmen gefährlich.
Überprüfen Sie bei Kontakt mit den Augen, ob Sie Kontaktlinsen tragen, und entfernen Sie diese sofort. Die Augen sollten mindestens 15 Minuten lang mit fließendem Wasser gespült werden, wobei die Augenlider offen bleiben sollten. Kaltes Wasser kann verwendet werden. Augensalbe sollte nicht verwendet werden.
Wenn die Chemikalie mit Kleidung in Kontakt kommt, entfernen Sie sie so schnell wie möglich, um Ihre eigenen Hände und Ihren Körper zu schützen. Stellen Sie das Opfer unter eine Sicherheitsdusche.
Wenn sich die Chemikalie auf der exponierten Haut des Opfers ansammelt, z. B. auf den Händen, wird die kontaminierte Haut vorsichtig und sorgfältig mit fließendem Wasser und nicht abrasiver Seife gewaschen..
Kaltes Wasser kann verwendet werden. Bei anhaltender Reizung einen Arzt aufsuchen. Waschen Sie die kontaminierte Kleidung, bevor Sie sie erneut verwenden.
Bei starkem Hautkontakt sollte diese mit einer Desinfektionsseife gewaschen und die kontaminierte Haut mit einer antibakteriellen Creme abgedeckt werden..
Im Falle einer Inhalation sollte das Opfer in einem gut belüfteten Bereich ruhen dürfen. Wenn die Inhalation schwerwiegend ist, sollte das Opfer so bald wie möglich an einen sicheren Ort evakuiert werden. Lösen Sie enge Kleidung wie Hemdkragen, Gürtel oder Krawatte.
Wenn das Opfer Schwierigkeiten beim Atmen hat, sollte Sauerstoff verabreicht werden. Wenn das Opfer nicht atmet, wird eine Mund-zu-Mund-Beatmung durchgeführt. Denken Sie immer daran, dass es für die Person, die Hilfe leistet, gefährlich sein kann, eine Mund-zu-Mund-Beatmung durchzuführen, wenn das eingeatmete Material giftig, infektiös oder ätzend ist..
Bei Verschlucken kein Erbrechen herbeiführen. Lösen Sie enge Kleidung wie Hemdkragen, Gürtel oder Krawatten. Wenn das Opfer nicht atmet, führen Sie eine Mund-zu-Mund-Beatmung durch. Suchen Sie in jedem Fall sofort einen Arzt auf..
Anwendungen
Es wurden Studien durchgeführt, in denen metastabile Chlorsäure / Chloroxid-Lösungen als Mundwasser zur Plaquereduktion verwendet werden (Goultschin J, 1989)..
Die Studie wurde an einer Gruppe von 18 Freiwilligen im Alter von 20 bis 27 Jahren durchgeführt. Die Wirkung auf die Plaqueentwicklung und die Anzahl der Speichelbakterien wurde getestet, wobei eine Verringerung der Zahnbelagwerte um bis zu 34,5% im Vergleich zu einer Placebogruppe erzielt wurde.
Chlorsäure ist an der Herstellung von Natriumsäurechlorit beteiligt, das antimikrobielle Eigenschaften aufweist und hauptsächlich als Sprüh- oder Tauchlösung für Geflügel, Fleisch, Gemüse, Obst und Meeresfrüchte verwendet werden soll. Wird auch in Geflügelkühlwasser verwendet.
Natriumsäurechlorit wird durch Zugabe einer Säure in Lebensmittelqualität (z. B. Zitronensäure, Phosphorsäure, Salzsäure, Äpfelsäure oder Natriumhydrogensulfat) zu einer wässrigen Lösung von Natriumchlorit (NaClO) hergestelltzwei).
Die Kombination der Säure mit der Natriumchloritlösung führt zur Umwandlung von Chlorit in metastabile Chlorsäure (HClO)zwei).
NaClOzwei + H.+ ⇌ HClOzwei + N / A+
Diese Lösung kann später mit Chlorit (ClO) eine Mischung bildenzwei-), Chlordioxid (ClOzwei) und Chlorid (Cl). Die Reaktion erzeugt eine oxidative Lösung mit oxychlorierten Spezies mit antimikrobiellen Eigenschaften.
Natriumsäurechlorit wurde als Teil eines integrierten Ansatzes zur Kontrolle der mikrobiellen Belastung von Lebensmitteln entwickelt.
Natriumsäurechloritlösung reduziert die Anzahl der Krankheitserreger (z. B. Escherichia coli, E. coli O157: H7, Salmonella spp., Campylobacter spp. Und Listeria monocytogenes) (Rao, 2006)..
Verweise
- J. Downs, C. J. (1973). Die Chemie von Chlor, Brom, Jod und Astatin: Pergamon…, Band 7. New York: Pergamonpresse.
- C. Hong, W. H. (1968). Kinetik der Disproportionierung von Chlorsäure. Canadian Journal of Chemistry 46 (12): , 2053-2060. nrcresearchpress.com.
- EMBL-EBI. (2014, 28. Juli). Chlorsäure. Von ChEBI wiederhergestellt: ebi.ac.uk..
- Goultschin J., G. J. (1989). Verwendung einer metastabilisierten Chlorsäure / Chlordioxid-Formulierung als Mundspülung zur Plaquereduktion. Isr J Dent Sci. 2 (3), 142-147. ncbi.nlm.nih.gov.
- Nationales Zentrum für Biotechnologie-Informationen… (2017, 30. April). PubChem Compound Database CID = 24453. Von PubChem abgerufen.
- Rao, M. V. (2006, Dezember). ACIDIFIED SODIUM CHLORITE (ASC) Chemische und technische Bewertung. Von fao.org wiederhergestellt.
- Royal Society of Chemistry. (2015). Chlorsäure. Von chemspider.com wiederhergestellt.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.