
Kohlenstoff 12 Kernnotation, Geschichte, Kommentare
Das Kohlenstoff-12 Es ist das am häufigsten vorkommende Isotop des Elements Kohlenstoff mit einer Häufigkeit von 98,93%. Darüber hinaus ist es hauptsächlich für alle Eigenschaften und Anwendungen verantwortlich, die dem Element Kohlenstoff zugeschrieben werden..
Das 12C mit einer Atommasse von genau 12 Dalton dient als Referenz für die Ermittlung der Atommassen der übrigen Nuklide. Das Atom von 12C besteht aus sechs Protonen, Neutronen und Elektronen; Die Masse der Elektronen wird jedoch als vernachlässigbar angesehen.
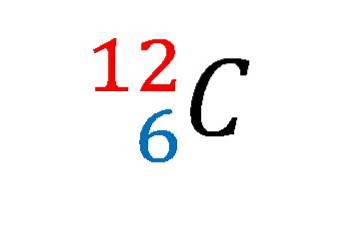
Elemente haben normalerweise Atommassen, ausgedrückt als ganze Zahlen, gefolgt von Dezimalstellen, da Elemente mehrere stabile Isotope haben können.
Daher werden die Atommassen der Elemente als gewichteter Durchschnitt der Atommassen ihrer verschiedenen Isotope ausgedrückt. In Anbetracht dessen, dass die 12C hat eine Häufigkeit von 98,93%, und die 13Bei einer Häufigkeit von 1,15% beträgt die Atommasse des Kohlenstoffs 12,011 Dalton.
Die Atommasse eines Elements wird als Durchschnitt der Atommassen seiner verschiedenen Atome in Bezug auf ein Zwölftel der Masse des Elements ausgedrückt. 12C, bekannt als einheitliche Atommasseneinheit; zuvor als "uma" abgekürzt und derzeit als "u".
Artikelverzeichnis
- 1 Kernnotation
- 2 Geschichte
- 3 Allgemeine Kommentare
- 4 Referenzen
Nukleare Notation
Im Bild oben wurde die Notation oder das Kernsymbol für das Isotop Kohlenstoff-12 gezeigt.
Die Beschreibung entspricht der Festlegung der Eigenschaften des Kohlenstoffatoms schlechthin. Seine Ordnungszahl 6 gibt die Anzahl der Protonen in seinem Kern an. Die Zahl 12 ist gleich der Summe der Protonen und Neutronen und ist daher die Atommasse; das ist proportional zur Kernmasse.
Und obwohl diese Notation es nicht zeigt, gibt es 6 Elektronen, die der positiven Ladung der Protonen im Kern entgegenwirken. Unter dem Gesichtspunkt chemischer Bindungen sind vier dieser sechs Elektronen diejenigen, die die Grundlagen des Lebens bilden, wie wir es kennen..
Geschichte
Daltons Forschungen (1810) zeigten, dass Wasser einen Sauerstoffanteil von 87,7% und Wasserstoff von 12,5% enthielt. Dalton wies jedoch darauf hin, dass die Formel für das Wasser OH war. Davy und Berzelius (1812) korrigierten die Formel für Wasser auf H.zweiODER.
Anschließend fand Berzelius die folgende Wasserzusammensetzung: Sauerstoff 88,8% und Wasserstoff 11,2%. Er ging davon aus, dass das Atomgewicht von Wasserstoff 1 g und das von Sauerstoff 16 g beträgt.
Dann erkannten sie, dass bei Verwendung des Atomgewichts von 1 g für Wasserstoff das Atomgewicht von Sauerstoff 15,9 g betragen würde. Dieser Grund führte unter anderem zur Festlegung der Atommasse von Sauerstoff von 16 g als Referenzstandard für die Atommassen der verschiedenen chemischen Elemente..
Sauerstoff wurde vom späten 19. Jahrhundert bis 1961 als Referenzstandard verwendet, als beschlossen wurde, Kohlenstoff als Referenzstandard für die Ermittlung der Atommassen der verschiedenen Elemente zu verwenden.
Vor 1959 verwendeten IUPAP und IUPAC das Element Sauerstoff, um das Mol wie folgt zu definieren: 1 Mol ist die Anzahl der in 16 g vorhandenen Sauerstoffatome.
Allgemeine Kommentare
Sprich darüber 12C soll sich auf Kohlenstoff als Ganzes beziehen; oder mindestens 98% seines Wesens, was für eine solche Annäherung ausreicht. Aus diesem Grund hat dieses Isotop an sich keine Verwendung, während das Element als solches und die von ihm integrierten Feststoffe Hunderte von Anwendungen abdecken..
Es ist jedoch zu beachten, dass lebende Organismen dieses Isotop besonders bevorzugen als dieses 13C; das heißt, der Prozentsatz von 13C oder die Beziehung 12C /13C variiert je nach Ökosystem, Region oder Tierart.
Dies kann möglicherweise daran liegen, dass Moleküle mit zu vielen Kohlenstoffatomen 13C, schwerer, behindern oder beeinträchtigen Stoffwechselprozesse und die Funktion der Körperzellen; auch wenn der Prozentsatz von 13C bei Lebewesen betrug etwas mehr als 1%.
deshalb, die 12C ist das Isotop des Kohlenstoffs, das für das Leben verantwortlich ist. Und der 14C der "Zeitmesser" seiner Überreste dank seines radioaktiven Zerfalls.
Ein weiterer indirekter Nutzen von 12C soll "Kontrast" für die Kernspinresonanzspektroskopietechnik der erzeugen 13C, mit dem die Kohlenstoffstruktur organischer Verbindungen aufgeklärt (entdeckt und konstruiert) werden kann.
Verweise
- Phillips, Basil. (08. Juli 2019). Was ist das häufigste Isotop von Kohlenstoff? sciencing.com. Wiederhergestellt von: sciencing.com
- César Tomé López. (2019). Von den Atomgewichten. Wiederhergestellt von: kulturacientifica.com
- ElSevier. (2019). Kohlenstoff-12. ScienceDirect. Wiederhergestellt von: sciencedirect.com
- R. Schiff. (s.f.). Nukleare Notation. Wiederhergestellt von: hyperphysics.phy-astr.gsu.edu
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.