
Struktur, Eigenschaften, Verwendungen von Lithiumcarbonat (Li2CO3)

Das Lithiumcarbonat ist ein anorganischer Feststoff, der aus zwei Lithium-Li-Kationen besteht+ und ein Carbonatanion CO3zwei-. Seine chemische Formel lautet LizweiCO3. Der LizweiCO3 ist ein weißer kristalliner Feststoff, der durch die Reaktion zwischen Lithiumhydroxid und Kohlendioxid erhalten werden kann.
Lithiumcarbonat hat einen sehr hohen Schmelzpunkt, weshalb es zur Herstellung von Gläsern, Keramiken und Porzellanen verwendet wird. Es hat eine Vielzahl von Anwendungen, beispielsweise in wiederaufladbaren Lithiumbatterien, bei der Herstellung anderer Lithiumverbindungen, in Schweißelektroden sowie in Farben und Lacken..

Li wird auch verwendetzweiCO3 in Zementmischungen für schnelles Abbinden und Aluminiumherstellung.
Eine der wichtigsten Anwendungen ist unter anderem die Behandlung einiger psychischer Erkrankungen wie Depressionen und übermäßig aggressiven Verhaltensweisen..
Die Verwendung als Arzneimittel muss jedoch von Fachärzten ordnungsgemäß kontrolliert werden, da Personen mit Li behandelt werdenzweiCO3 kann gesundheitsschädliche Auswirkungen haben, wie z. B. Hypothyreose (verminderte Funktion der Schilddrüse).
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Physikalische Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Zersetzung
- 3.5 Dichte
- 3.6 Löslichkeit
- 3,7 pH
- 4 Chemische Eigenschaften
- 5 Biologische Eigenschaften
- 6 Erhalten
- 7 Verwendungen
- 7.1 Bei der Behandlung von psychischen Erkrankungen
- 7.2 Bei der Behandlung von Symptomen anderer Krankheiten
- 7.3 Art der Verabreichung
- 8 Nebenwirkungen
- 8.1 Fälle, in denen es nicht verabreicht werden sollte
- 9 Andere Verwendungen
- 10 Referenzen
Struktur
Lithiumcarbonat besteht aus zwei Lithium-Li-Kationen+ und ein Carbonatanion CO3zwei-.
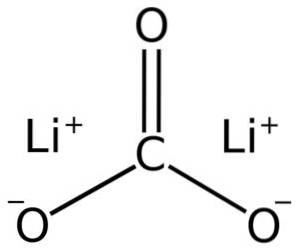
Die Elektronenkonfiguration von Lithium im Oxidationszustand +1 beträgt 1szwei 2s0, da es das Elektron der letzten Schale verloren hat und somit stabiler ist. Das Carbonation CO3zwei- hat eine flache Struktur.
Negative Ladungen sind gleichmäßig auf die drei Sauerstoffatome des Carbonationen CO verteilt3zwei-.
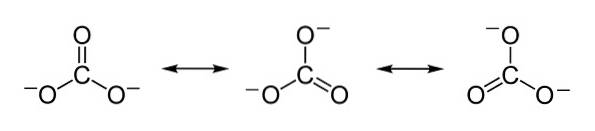
Nomenklatur
-Lithiumcarbonat
-Dilithiumcarbonat
Physikalische Eigenschaften
Körperlicher Status
Weißer kristalliner Feststoff mit monokliner Struktur
Molekulargewicht
73,9 g / mol
Schmelzpunkt
723 ºC
Zersetzung
Es zersetzt sich bei 1300 ºC.
Dichte
2,11 g / cm3
Löslichkeit
In Wasser schwer löslich: 1,31 Gew .-% bei 20 ºC. Seine Löslichkeit in Wasser nimmt mit zunehmender Temperatur ab. Es ist in verdünnten Säuren löslich. Es ist unlöslich in Alkohol und Aceton.
pH
Lösungen in Wasser sind alkalisch und haben einen pH-Wert von mehr als 7.
Chemische Eigenschaften
Der LizweiCO3 hydrolysiert in wässriger Lösung unter Bildung einer basischen Lösung. Der geringe Anteil der in Wasser gelösten Verbindung lässt das Carbonatanion CO frei.3zwei-.
Das Carbonatanion CO3zwei- frei in wässriger Lösung nimmt ein Proton, um das Bicarbonatanion HCO zu bilden3-, wie in der folgenden Reaktion zu sehen ist:
CO3zwei- + H.zweiO → HCO3- + Oh-
Das Vorhandensein von OH-Ionen- macht die Lösung grundlegend.
Biologische Eigenschaften
Spuren von Lithiumionen sind normalerweise in tierischen und menschlichen Geweben vorhanden, aber bisher ist keine natürliche physiologische Rolle dieses Ions bekannt..
Im menschlichen Organismus ist der LizweiCO3 Als Medikament aufgenommen, wirkt es auf eine Vielzahl von Signalmechanismen in Neuronen und anderen Zellen. Dies resultiert aus der Substitution von Kationen wie Natrium und Kalium.
Der Einbau von Lithiumionen in die Struktur der Zellmembran kann die Reaktion auf Hormone und die Kopplung der Zelle mit Energieprozessen verändern.
Auf diese Weise modifiziert Lithium mehrere zelluläre Prozesse, einschließlich des Stoffwechsels..
Durch die Veränderung der Funktionsweise von Zellen kann LizweiCO3 kann auf die Kommunikationsmechanismen von Neuronen im Gehirn einwirken.
Erhalten
Der LizweiCO3 kann durch Reaktion von Lithiumhydroxid LiOH mit Kohlendioxid CO erhalten werdenzwei, Wie nachfolgend dargestellt:
2 LiOH + COzwei → LizweiCO3 + H.zweiODER
Es wird kommerziell aus lithiumhaltigen Mineralien wie Spodumen und Lepidolit hergestellt. Diese Mineralien werden bei hohen Temperaturen mit bestimmten Sulfatsalzen oder mit alkalischen Verbindungen behandelt, um Lithiumsalze zu erhalten..
Die erhaltenen Lithiumsalze werden mit Wasser oder sauren Lösungen gereinigt und dann mit Carbonaten behandelt, um Li zu bildenzweiCO3.
Die LizweiCO3 Auf diese Weise erreicht, ist es mit Sulfaten oder Chloriden von Calcium, Magnesium, Eisen, Natrium, Kalium usw. kontaminiert. daher ist eine weitere Reinigung erforderlich.
Anwendungen
Bei der Behandlung von psychischen Erkrankungen
Es wird als Antidepressivum, Antimanikum, zur Behandlung von aggressiv-impulsiven Verhaltensweisen und bei bipolaren Störungen (Menschen, die plötzlich ohne Grund ihre Stimmung ändern und gewalttätig werden) verwendet..

Ärzte haben beobachtet, dass seine Verabreichung zu einer Abnahme der Intensität und Häufigkeit schwerer Perioden von Depressionen und manischen Episoden führt..
Es wird allein, dh ohne Zusatz einer Verbindung, in der Erhaltungstherapie der unipolaren Depression und bei schizoaffektiven Störungen angewendet. Es dient auch dazu, die antidepressive Wirkung anderer Medikamente zu erhöhen.
Obwohl es zur Behandlung von Kindern mit offensichtlichen Symptomen einer bipolaren Störung und Hyperaktivität mit neurotischen oder aggressiven Komponenten angewendet wurde, war es nicht in allen Fällen wirksam..
Bei der Behandlung von Symptomen anderer Krankheiten
Es wird verwendet, um die Häufigkeit schwerer, wiederkehrender und chronischer Kopfschmerzen zu reduzieren.
Es wird verwendet, um die Inzidenz von Infektionen bei Patienten mit durch Chemotherapie oder aus anderen Gründen induzierter Neutropenie zu verringern. Neutropenie ist eine Abnahme der Neutrophilen, einer Art weißer Blutkörperchen, die bei der Bekämpfung von Infektionen im Körper hilft.
Es wurde als Schilddrüsenenzymhemmer zur Behandlung von Hyperthyreose verwendet, ist jedoch aufgrund seiner nachteiligen Wirkungen nicht die bevorzugte Behandlung.
Form der Verabreichung
Es wird in Form von Tabletten oder Kapseln von Li verwendetzweiCO3. Auch in langsam freisetzenden Tabletten mit Lithiumcitrat. Li ist bevorzugtzweiCO3 weil es den Hals beim Verschlucken nicht reizt, wie es bei anderen Lithiumsalzen der Fall ist.

Nebenwirkungen
Der LizweiCO3 kann schädliche Auswirkungen auf die Schilddrüse und die Nieren haben, daher sollte die Funktion dieser Organe vor und während der Behandlung mit dieser Verbindung überwacht werden..
Der LizweiCO3 Es kann in Konzentrationen toxisch sein, die denen in medizinischen Behandlungen sehr nahe kommen. Daher ist eine kontinuierliche Überprüfung seiner Werte im Blutserum erforderlich.
Symptome einer Li-VergiftungzweiCO3 Dies sind unter anderem Zittern, Muskelkrämpfe, Muskelschwäche, Durchfall, Erbrechen, Schläfrigkeit oder Ataxie (beeinträchtigte Muskelkoordination).
Zu Beginn der Therapie mit LizweiCO3 Symptome wie Zittern, Kopfschmerzen und Übelkeit können ebenfalls auftreten. Aber diese neigen dazu, zu verschwinden, wenn die Medikation fortgesetzt wird..
Die meisten behandelten Personen können auch eine Leukozytose entwickeln (eine Zunahme der Anzahl weißer Blutkörperchen), dies ist jedoch reversibel..
Menschen, die mit Li behandelt werdenzweiCO3 Sie sollten keine Fahrzeuge fahren oder Maschinen bedienen, da die körperliche Koordination und die Fähigkeit, Aktivitäten auszuführen, die Wachsamkeit erfordern, abnehmen.
Fälle, in denen es nicht verabreicht werden sollte
Es sollte nicht bei Kindern unter 12 Jahren angewendet werden, da es die Knochenbildung und deren Dichte beeinträchtigen kann, da es die Konzentrationen eines Schilddrüsenhormons verändert. Es neigt auch dazu, den Platz von Kalzium in den Knochen einzunehmen..
Sie sollten nicht mit Li behandelt werdenzweiCO3 Menschen mit Herz-Kreislauf-, Nieren- oder Schilddrüsenerkrankungen. Weder bei stark dehydrierten Patienten.
Es sollte schwangeren Frauen nicht verabreicht werden, insbesondere nicht während des ersten Schwangerschaftstrimesters. Lithium passiert die Plazenta und kann den Fötus mit möglichen teratogenen Effekten leicht erreichen, dh es kann beim ungeborenen Baby Anomalien oder Missbildungen verursachen..
Ältere Menschen, die eine Behandlung mit Li benötigenzweiCO3 sollten mit großer Sorgfalt und mit Dosen behandelt werden, die niedriger sind als die junger Erwachsener, da sie eine Schilddrüsenunterfunktion entwickeln können.
Andere Verwendungen
Der LizweiCO3 Bei der Herstellung von wiederaufladbaren Lithiumbatterien wird häufig eine hohe Reinheit verwendet.
Wird in Brennstoffzellen aus geschmolzenem Carbonat verwendet.
Es wird bei der Herstellung von elektrischem Porzellan verwendet, bei dem es sich um eine Art elektrisch isolierendes Porzellan handelt. Es wird auch zur Herstellung von Glasuren auf Keramik verwendet.

Es ermöglicht die Herstellung von Keramiken mit einem niedrigen Ausdehnungskoeffizienten, dh es dehnt sich mit zunehmender Temperatur sehr wenig aus, so dass die Keramik in einem höheren Temperaturbereich verwendet werden kann.
Andere Anwendungen sind als Katalysator, bei der Herstellung anderer Lithiumverbindungen, als Beschichtung für Schweißelektroden, in Lumineszenzfarbenformeln, Lacken und Farbstoffen sowie bei der elektrolytischen Herstellung von Aluminium..
Es ist nützlich, eine schnellere Abbindung des Zements zu erzielen und dem Kleber der Fliesen zuzusetzen, damit diese in kurzer Zeit fixiert werden können.

Verweise
- Cai, W. et al. (2018). Entfernung von SO4zwei- von LizweiCO3 durch Rekristallisation in NazweiCO3. Kristalle 2018, 8, 19. Von mdpi.com wiederhergestellt.
- Gadikota, G. (2017). Verbindung der morphologischen und kristallstrukturellen Veränderungen während der Umwandlung von Lithiumhydroxidmonohydrat in Lithiumcarbonat mithilfe von mehrskaligen Röntgenstreumessungen. Minerals 2017, 7, 169. Von mdpi.com wiederhergestellt.
- UNS. Nationalbibliothek für Medizin. (2019). Lithiumcarbonat. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Vierte Edition. John Wiley & Sons.
- Ullmanns Enzyklopädie der Industriechemie. (1990). Fünfte Ausgabe. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.