
Latente Wärme

Was ist latente Wärme??
Latente Wärme ist die Wärmemenge, die ein Stoff aufnehmen oder abgeben muss, um seinen physikalischen Zustand oder seine physikalische Phase zu ändern, wobei die Temperatur während dieses Prozesses konstant gehalten wird. Die zugeführte oder abgegebene Wärme manifestiert sich nicht, sie "fühlt" sich nicht wie bei einer Temperaturschwankung üblich an; daher der Begriff latente Wärme.
Das latente Wort kommt vom lateinischen Wort "latens", was "versteckt" bedeutet. Latente Wärme verhält sich also so, als ob sie nicht existierte, wenn die Temperatur konstant gehalten wurde. Aber es existiert: Was passiert, ist, dass es im Phasenwechsel oder im physischen Zustand vollständig verbraucht ist.
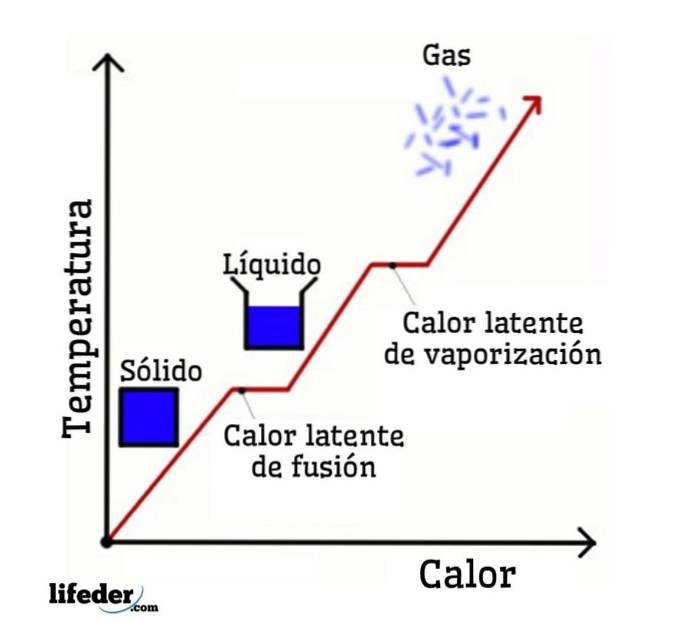
Am Beispiel von Wasser sind die Phasenänderungen wie folgt: Eis (fest) schmilzt in einem als Schmelzen bezeichneten Prozess zu flüssigem Wasser (flüssig); und flüssiges Wasser verdampft wiederum, um sich in einem als Verdampfung bezeichneten Prozess in Wasserdampf (Gas) umzuwandeln.
Andererseits wird Wasserdampf in einem als Kondensation bezeichneten Prozess zu flüssigem Wasser abgekühlt; und flüssiges Wasser wird in einem als Verfestigung bezeichneten Prozess wieder zu Eis.
Jede dieser Phasenänderungen ist mit einer latenten Wärme verbunden, die positiv (Absorption) oder negativ (Freisetzung) sein kann..
Latente Schmelzwärme

Dies ist die Wärmemenge, die einer bestimmten Menge an fester Substanz zugeführt werden muss, um ihren physikalischen Zustand von fest zu flüssig zu ändern. Während des Schmelzens gibt es keine Temperaturänderung. Während der Feststoff schmilzt oder schmilzt, hat die daraus erzeugte Flüssigkeit die gleiche Temperatur wie der gesamte Feststoff.
Im Allgemeinen wird diese Wärme am normalen Schmelzpunkt bestimmt, bei dem es sich um die Temperatur handelt, bei der der Feststoff unter atmosphärischem Druck zu schmelzen beginnt. Bei dieser Temperatur besteht gleichzeitig ein Gleichgewicht oder das gleichzeitige Vorhandensein des festen und des flüssigen Zustands..
Der feste Zustand ist durch das Vorhandensein einer kompakten Struktur aufgrund des Vorhandenseins hochenergetischer chemischer Bindungen gekennzeichnet, die ihm strukturelle Steifheit verleihen. Für die Umwandlung eines Feststoffs in eine Flüssigkeit müssen diese Wechselwirkungen unterbrochen werden, damit zu diesem Zweck Energie verbraucht (absorbiert) wird.
Ein typisches Beispiel ist der Verzehr eines Eises aus Wasser, Zucker und anderen Substanzen. Es ist üblich zu beobachten, dass Eiscreme, wenn es nicht schnell verzehrt wird, zu schmelzen beginnt, dh zu schmelzen. Dies tritt auf, wenn die Temperatur des Eises den Schmelzpunkt des Eises erreicht..
Beispiele
Einige Beispiele für latente Schmelzwärmen, ausgedrückt in J / g, werden aufgelistet; das heißt, die Energie, die ein Gramm Feststoff aufnehmen muss, um am Schmelzpunkt zu schmelzen:
-Eis 334.0
-Aluminium 380.0
-Schwefel 38.1
-Kupfer 134.0
-Ethanol 104.0
-Quecksilber 11.8
-Gold 64,5
-Silber 80,3
-Blei 24.5
-Wolfram 184
Eis nimmt viel Wärme auf, nicht weil seine Wechselwirkungen stärker sind, sondern weil es in der Lage ist, Wärme außergewöhnlich zwischen seinen Kristallen abzuleiten..
Latente Verdampfungswärme
Es ist die Wärmemenge, die eine bestimmte Substanzmenge absorbiert, um beim normalen Siedepunkt von einem flüssigen in einen gasförmigen Zustand überzugehen. Das heißt, es ist die Wärme, die die Flüssigkeit aufnimmt, wenn sie kocht und sich ohne Temperaturerhöhung in Gas verwandelt..
Innerhalb der Flüssigkeit können die Moleküle der Substanzen durch Bildung von Wasserstoffbrückenbindungen und durch Anziehungskräfte zwischen den Molekülen interagieren. Um eine Substanz vom flüssigen in den gasförmigen Zustand zu überführen, müssen diese Kräfte überwunden und Wärme zugeführt werden.
Sensible Wärme absorbiert die Flüssigkeit nur, um ihre Temperatur zu erhöhen, die von ihrer spezifischen Wärme abhängt. In der Zwischenzeit wird die latente Verdampfungswärme genutzt, um sie direkt in Dampf umzuwandeln, was am Siedepunkt viel einfacher ist..
Beispiele
Nachfolgend sind Beispiele einiger Flüssigkeiten mit ihren jeweiligen latenten Verdampfungswärmen aufgeführt, die wiederum in J / g ausgedrückt werden:
-Essigsäure 402
-Aceton 518
-Wasser 2256
-Ethylalkohol 846
-Schwefel 1510
-Benzol 390
-Kohlendioxid 574
-Chlor 293
-Ether 377
-Glycerin 974
-Quecksilber 295
-Sauerstoff 214
Beachten Sie die enorme latente Wärme von flüssigem Wasser: 1 g flüssiges Wasser (ca. 1 ml) muss 2256 J absorbieren, um zu verdampfen. Flüssiges Wasser leitet die Wärme, die es erhält, im Vergleich zu Eis noch besser ab.
Latente Erstarrungswärme
Es ist die Wärme, die eine bestimmte Menge Substanz abgeben muss, um zum Zeitpunkt der Verfestigung oder des Gefrierens von ihrem flüssigen in ihren festen Zustand überzugehen. Wiederum bleibt die Temperatur konstant, bis sich die Flüssigkeit vollständig verfestigt hat..
Der Erstarrungsprozess ist die Umkehrung des Schmelzprozesses, daher sind die Werte der latenten Erstarrungswärme und die der latenten Schmelzwärme gleich, jedoch mit entgegengesetzten Vorzeichen..
Die Moleküle einer Substanz im flüssigen Zustand bewegen sich aufgrund der Energie, die sie besitzen, mit einer gewissen Freiheit. Um in die feste Phase überzugehen, müssen die Moleküle daher Energie in Form von Wärme freisetzen, was eine stärkere Wechselwirkung zwischen den Molekülen der Substanz ermöglicht..
Die Wechselwirkung zwischen den Molekülen begünstigt die Bildung der chemischen Bindungen der festen Phase. Ein Beispiel hierfür ist, wenn flüssiges Wasser in die eisbildenden Behälter im Kühlschrank mit Gefrierfach gegeben wird. Der Gefrierschrank entzieht dem flüssigen Wasser Wärme und verfestigt sich zu Eis.
Beispiele
Einige Beispiele für latente Erstarrungswärmen (in J / g) für einige Flüssigkeiten sind nachstehend aufgeführt:
-Wasser (-334)
-Aluminium (-380)
-Schwefel (-38)
-Kupfer (-134)
-Ethanol (-104)
Latente Kondensationswärme
Es ist die Wärmemenge, die von einer bestimmten Substanzmenge abgegeben oder abgegeben werden muss, um vom gasförmigen in den flüssigen Zustand zu gelangen. Das kondensierende Gas und die gebildete Flüssigkeit halten während der Kondensation die gleiche Temperatur aufrecht.
Kondensation ist das Gegenteil von Verdampfung. Die latente Kondensationswärme hat den gleichen Wert wie die latente Verdampfungswärme, jedoch mit dem entgegengesetzten Vorzeichen und am Siedepunkt. Ein Beispiel hierfür ist das Kochen und Kondensieren von Dampf auf der Innenseite der Töpfe..
Gasförmige Moleküle bewegen sich frei, angetrieben von der Energie, die sie besitzen. Daher müssen sie Energie freisetzen, damit sich die intermolekularen Wechselwirkungen des flüssigen Zustands zwischen den Molekülen der Substanz herstellen können..
In der Natur gibt es viele andere Beispiele für das Phänomen der Wasserkondensation. Wasserdampf steigt in der Atmosphäre auf und kondensiert in Form von Wassertropfen in den Wolken.
Das Vorhandensein von Wassertropfen in Autofenstern wird auch als Folge der Kondensation von Wasser aufgrund eines Temperaturabfalls am frühen Morgen beobachtet, der den sogenannten Tau bildet.
Beispiele
Schließlich werden für einige Dämpfe ihre jeweiligen latenten Kondensationswärmen, die noch einmal in J / g ausgedrückt werden, aufgelistet:
-Essigsäure (-402)
-Aceton (-518)
-Wasser (-2256)
-Ethylalkohol (-846)
-Schwefel (-1510)
-Benzol (-390)
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Walter J. Moore. (1963). Physikalische Chemie. In der chemischen Kinetik. Vierte Ausgabe, Longmans.
- Wikipedia. (2020). Latente Wärme. Wiederhergestellt von: en.wikipedia.org
- Die Herausgeber der Encyclopaedia Britannica. (2020). Latente Wärme. Wiederhergestellt von: britannica.com
- Engineering ToolBox. (2003). Flüssigkeiten: Latente Verdunstungswärme. Wiederhergestellt von: engineeringingtoolbox.com
- Lumen lernen. (s.f.). Phasenwechsel und latente Wärme. Wiederhergestellt von: course.lumenlearning.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.