
Butanal Struktur, Eigenschaften, Verwendungen und Risiken
Das Butanal es ist ein offenkettiger Aldehyd, der aus vier Kohlenstoffatomen besteht und analog zu Butan ist; es ist tatsächlich die am zweithäufigsten oxidierte Form des Kohlenwasserstoffbutans nach Buttersäure. Seine Summenformel lautet CH3CHzweiCHzweiCHO, wobei -CHO die Formylgruppe ist.
Dieser Aldehyd, einer der leichtesten, besteht aus einer transparenten, brennbaren Flüssigkeit, die weniger dicht als Wasser ist. Darüber hinaus ist es wasserlöslich und mit den meisten organischen Lösungsmitteln mischbar. Daher kann es verwendet werden, um einphasige organische Gemische zu haben.
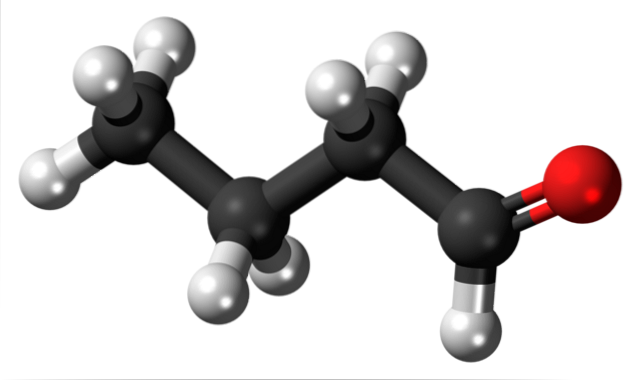
Das Vorhandensein der Carbonylgruppe (die der roten Kugel, oberes Bild) verleiht dem Butanalmolekül eine chemische Polarität und damit die Fähigkeit, die Dipol-Dipol-Wechselwirkung zwischen seinen Molekülen zu erfahren. obwohl keine Wasserstoffbrücken zwischen ihnen gebildet werden.
Dies führt dazu, dass Butanal höhere Siede- und Schmelzpunkte als Butan aufweist, jedoch niedriger als die von n-Butylalkohol angegebenen..
Butanal wird als Lösungsmittel verwendet und ist ein Zwischenprodukt, um zahlreiche Produkte zu erhalten. wie Vulkanisationsbeschleuniger für Kautschuke, Harze, Pharmazeutika und Agrochemikalien.
Butanal ist eine toxische Verbindung, die beim Einatmen Entzündungen der oberen Atemwege, Bronchien und Lungenödeme verursachen kann, die sogar tödliche Folgen haben können.
Artikelverzeichnis
- 1 Struktur von Butanal
- 1.1 Konformere
- 2 Eigenschaften
- 2.1 Chemische Namen
- 2.2 Summenformel
- 2.3 Aussehen
- 2.4 Geruch
- 2,5 Siedepunkt
- 2.6 Schmelzpunkt
- 2.7 Flammpunkt
- 2.8 Löslichkeit in Wasser
- 2.9 Löslichkeit in organischen Lösungsmitteln
- 2.10 Dichte
- 2.11 Dampfdichte
- 2.12 Dampfdruck
- 2.13 Selbstentzündung
- 2.14 Viskosität
- 2.15 Verbrennungswärme
- 2.16 Verdampfungswärme
- 2.17 Oberflächenspannung
- 2.18 Geruchsschwelle
- 2.19 Brechungsindex
- 2,20 Dipolmoment
- 2.21 Wellenlängen (λ) der maximalen Absorption in Wasser
- 2.22 Polymerisation
- 2.23 Reaktivität
- 2.24 Aldolkondensation
- 3 Synthese
- 4 Verwendungen
- 4.1 Industrie
- 4.2 Andere
- 5 Risiken
- 6 Referenzen
Butanalstruktur
Es wurde gerade erwähnt, dass die Formylgruppe -CHO dem Butanal- oder Butyraldehydmolekül aufgrund der höheren Elektronegativität des Sauerstoffatoms Polarität verleiht. Infolgedessen können seine Moleküle durch Dipol-Dipol-Kräfte miteinander interagieren..
Im oberen Bild wird anhand eines Modells von Kugeln und Balken gezeigt, dass das Butanalmolekül eine lineare Struktur aufweist. Der Kohlenstoff der -CHO-Gruppe weist eine sp-Hybridisierung aufzwei, während die verbleibenden Kohlenstoffe sp Hybridisierung3.
Nicht nur das, sondern es ist auch flexibel und seine Glieder können sich um ihre eigenen Achsen drehen. und somit werden unterschiedliche Konformationen oder Konformere erzeugt (gleiche Verbindung, jedoch mit gedrehten Gliedern).
Konformere
Das folgende Bild erklärt diesen Punkt besser:
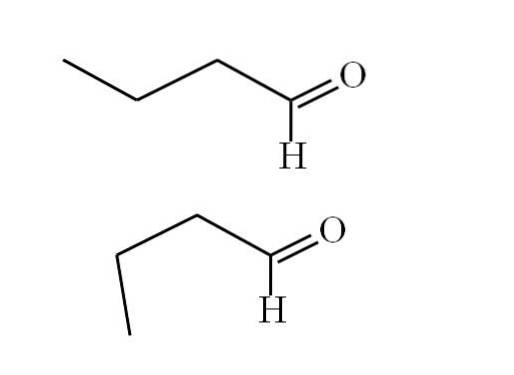
Der erste Konformer (der obere) entspricht dem Molekül im ersten Bild: die Methylgruppe links, -CH3, und die Gruppe -CHO befinden sich in Positionen, die antiparallel zueinander sind; einer zeigt nach oben und der andere nach unten.
Währenddessen entspricht der zweite Konformer (der untere) dem Molekül mit -CH3 und der -CHO in verdeckten Positionen; Das heißt, beide zeigen in die gleiche Richtung.
Beide Konformere sind schnell austauschbar, und daher dreht und vibriert das Butanalmolekül ständig. und fügte hinzu, dass es einen permanenten Dipol hat, wodurch seine Wechselwirkungen stark genug sind, um bei 74,8ºC zu kochen..
Eigenschaften
Chemische Namen
-Butanal
-Butyraldehyd
-1-Butanal
-Butyral
-N-Butyraldehyd.
Molekularformel
C.4H.8O oder CH3CHzweiCHzweiCHO.
Aussehen
Es ist eine klare, transparente Flüssigkeit.
Geruch
Charakteristischer, stechender Aldehydgeruch.
Siedepunkt
74,8 ° C (167ºF bis 760 mmHg).
Schmelzpunkt
--96,86 ºC (146 ºF).
Zündpunkt
-8ºF (-22ºC) geschlossene Tasse.
Wasserlöslichkeit
7 g / 100 ml bei 25 ° C..
Löslichkeit in organischen Lösungsmitteln
Mit Ethanol, Ether, Ethylacetat, Aceton, Toluol und vielen anderen organischen Lösungsmitteln mischbar.
Dichte
0,803 g / cm3 bei 68ºF.
Wasserdampfdichte
2,5 (in Bezug auf Luft gleich 1).
Dampfdruck
111 mmHg bei 25 ºC.
Selbstentzündung
446ºF. 21,8 ° C (425ºF).
Viskosität
0,45 cPoise bei 20 ° C..
Verbrennungswärme
2479,34 kJ / mol bei 25 ºC.
Verdampfungswärme
33,68 kJ / mol bei 25 ° C..
Oberflächenspannung
29,9 dyn / cm bei 24 ºC.
Geruchsschwelle
0,009 ppm.
Brechungsindex
1,3843 bei 20 ºC.
Dipolmoment
2,72 D..
Wellenlängen (λ) der maximalen Absorption in Wasser
225 nm und 282 nm (ultraviolettes Licht).
Polymerisation
Butanal kann in Kontakt mit Laugen oder Säuren polymerisieren, wobei die Polymerisation gefährlich ist.
Reaktivität
Wenn es Luft ausgesetzt wird, oxidiert es unter Bildung von Buttersäure. Bei einer Temperatur von 230 ° C entzündet sich Butanal spontan mit Luft.
Aldolkondensation
Zwei Butanalmoleküle können in Gegenwart von KOH und einer Temperatur von 6 bis 8 ° C unter Bildung der Verbindung 2-Ethyl-3-hydroxyhexanol miteinander reagieren. Diese Art von Verbindung wird Aldol genannt, da sie in ihrer Struktur eine Aldehydgruppe und eine alkoholische Gruppe aufweist.
Synthese
Butanal kann durch katalytische Dehydrierung von n-Butylalkohol hergestellt werden; die katalytische Hydrierung von Crotonaldehyd; und die Hydroformylierung von Propylen.
Anwendungen
Industriell
-Butanal ist ein industrielles Lösungsmittel, aber es ist auch ein Zwischenprodukt bei der Synthese anderer Lösungsmittel. zum Beispiel 2-Ethylhexanol, n-Butanol und Trimethylpropan.
-Es wird auch als Zwischenprodukt bei der Herstellung von Kunstharzen verwendet, einschließlich Polyvinylbutyral; Beschleuniger für die Vulkanisation von Gummi; Herstellung von pharmazeutischen Produkten; Pflanzenschutzmittel; Pestizide; Antioxidantien; Bräunungshilfen.
-Butanal wird als Rohstoff für die Herstellung synthetischer Aromen verwendet. Darüber hinaus wird es als Lebensmittelaromastoff verwendet.
Andere
-Beim Menschen wird Butanal als Biomarker verwendet, der auf eine oxidative Schädigung von Lipiden, Proteinen und Nukleinsäuren hinweist.
-Es wurde experimentell zusammen mit Formalin und Glutardehyd verwendet, um zu versuchen, die Erweichung der Hufe von Rindern aufgrund der Exposition gegenüber Wasser, Urin und Kot der Rinder selbst zu verringern. Die experimentellen Ergebnisse waren positiv.
Risiken
Butanal zerstört die Schleimhautmembranen der oberen Atemwege sowie das Gewebe von Haut und Augen..
Durch Hautkontakt entstehen Rötungen und Verbrennungen. In den Augen treten die gleichen Verletzungen auf, begleitet von Schmerzen und Schäden am Augengewebe.
Das Einatmen von Butanal kann schwerwiegende Folgen haben, da es Entzündungen und Ödeme im Kehlkopf und in den Bronchien verursachen kann. In der Lunge kommt es zu einer chemischen Lungenentzündung und einem Lungenödem.
Anzeichen einer Überbelichtung sind: Brennen in den oberen Atemwegen, Husten, Keuchen, dh Keuchen beim Atmen; Kehlkopfentzündung, Atemnot, Kopfschmerzen, Übelkeit und auch Erbrechen.
Das Einatmen kann infolge eines Krampfes der Atemwege tödlich sein.
Die Einnahme von Butanal verursacht ein Gefühl des "Brennens" im Verdauungstrakt: Mundhöhle, Rachen, Speiseröhre und Magen.
Verweise
- Morrison, R. T. und Boyd, R. N. (1987). Organische Chemie. (5ta Auflage.). Editorial Addison-Wesley Iberoamericana.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- PubChem. (2019). Butanal. Wiederhergestellt von: pubchem.ncbi.nim.nih.guv
- Wikipedia. (2019). Butanal. Wiederhergestellt von: es.wikipedia.org
- Chemisches Buch. (2017). Butanal. Wiederhergestellt von: Chemicalbook.com
- Basf. (Mai 2017). N-Butyraldehyd. [PDF]. Wiederhergestellt von: solvents.basf.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.