
Lithiumbromidstruktur, Eigenschaften, Verwendungen, Risiken
Das Lithiumbromid Es ist ein neutrales Salz eines Alkalimetalls, dessen chemische Formel LiBr ist. Die Formel drückt aus, dass sein kristalliner Feststoff aus Li-Ionen besteht+ und Br- im Verhältnis 1: 1. Seine Kristalle sind weiß oder hellbeige. Es ist sehr gut wasserlöslich und es ist auch ein ziemlich hygroskopisches Salz..
Diese letzte Eigenschaft ermöglicht die Verwendung als Trockenmittel in Klima- und Kühlsystemen. Ebenso wurde Lithiumbromid seit Beginn des 20. Jahrhunderts zur Behandlung bestimmter psychischer Störungen verwendet, wobei seine Verwendung aufgrund einer unangemessenen Verwendung von Salz eingestellt wurde.
LiBr wird durch Behandlung von Lithiumcarbonat Li hergestelltzweiCO3, mit Bromwasserstoffsäure. Nach dem Erhitzen fällt das Medium als Hydrat aus der wässrigen Lösung aus..
Dieses Salz reizt bei Kontakt Haut und Augen, während es durch Einatmen die Atemwege reizt. Die Einnahme von Lithiumsalzen kann Übelkeit, Erbrechen, Durchfall und Schwindel verursachen.
Artikelverzeichnis
- 1 Struktur von Lithiumbromid
- 1.1 Hydrate und Gläser
- 2 Eigenschaften
- 2.1 Molekulargewicht
- 2.2 Aussehen
- 2.3 Geruch
- 2.4 Schmelzpunkt
- 2,5 Siedepunkt
- 2.6 Löslichkeit in Wasser
- 2.7 Löslichkeit in organischen Lösungsmitteln
- 2.8 Brechungsindex (ηD)
- 2.9 Wärmekapazität
- 2.10 Standardmolare Entropie (Sθ 298)
- 2.11 Flammpunkt
- 2.12 Stabilität
- 2.13 Zersetzung
- 2,14 pH
- 2.15 Reaktivität
- 2.16 Produktion
- 3 Nomenklatur
- 4 Verwendungen
- 4.1 Trockenmittel
- 4.2 Fasern
- 4.3 Pharmazeutische Produkte
- 4.4 Beruhigungsmittel
- 5 Risiken
- 5.1 Kontakttoxizität
- 5.2 Verschlucken
- 6 Referenzen
Struktur von Lithiumbromid
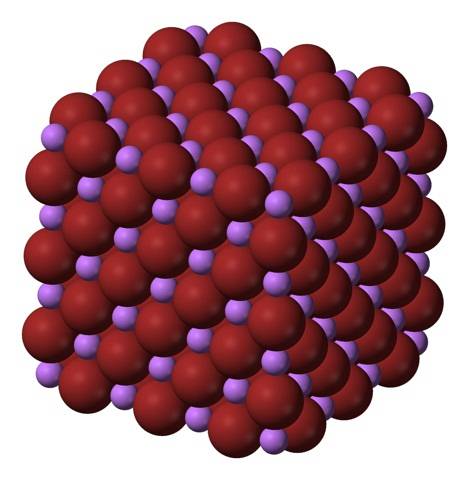
Die LiBr-Formel macht deutlich, dass das Li / Br-Verhältnis gleich 1 ist; für jedes Li-Kation+ Es muss ein Br-Anion geben- Gegenstück. Daher muss dieses Verhältnis in allen Ecken des LiBr-Kristalls konstant gehalten werden..
Li-Ionen+ und Br- sie ziehen sich gegenseitig an und verringern die Abstoßung zwischen gleichen Ladungen, um auf diese Weise einen kubischen Kristall wie Edelsteinsalz hervorzubringen; Dies ist isomorph zu NaCl (oberes Bild). Beachten Sie, dass die gesamte Menge selbst eine kubische Geometrie hat.
In diesem Kristall ist das Li+ sie sind kleiner und haben eine hellviolette Farbe; während der Br- Sie sind voluminöser und von tiefbrauner Farbe. Es wird beobachtet, dass jedes Ion sechs Nachbarn hat, was gleichbedeutend ist mit der Aussage, dass sie eine oktaedrische Koordination aufweisen: LiBr6 oder Li6Br; Wenn jedoch die Einheitszelle berücksichtigt wird, bleibt das Li / Br-Verhältnis 1.
Dies ist die Kristallstruktur, die vorzugsweise von LiBr übernommen wird. Es kann jedoch auch andere Arten von Kristallen bilden: Wurzit, wenn es bei niedrigen Temperaturen (-50 ° C) auf einem Substrat kristallisiert; oder körperzentrierter kubischer oder CsCl-Typ, wenn der kubische Edelsteinsalzkristall unter hohem Druck steht.
Hydrate und Gläser
Das Vorstehende gilt für wasserfreies LiBr. Dieses Salz ist hygroskopisch und kann daher Feuchtigkeit aus der Umgebung aufnehmen und Wassermoleküle in seine eigenen Kristalle einbringen. Somit entstehen die Hydrate LiBrnHzweiO (n = 1, 2, 3…, 10). Für jedes Hydrat ist die Kristallstruktur unterschiedlich.
Beispielsweise stellten kristallographische Studien fest, dass LiBrHzweiOder nehmen Sie eine Perowskit-ähnliche Struktur an.
Wenn diese Hydrate in wässriger Lösung vorliegen, können sie unterkühlt und verglast werden. das heißt, sie nehmen eine scheinbar kristalline, aber molekular ungeordnete Struktur an. Unter solchen Bedingungen werden Wasserstoffbrückenbindungen in Wasser sehr wichtig..
Eigenschaften
Molekulargewicht
88,845 g / mol.
Aussehen
Weißer oder hellbeiger kristalliner Feststoff.
Geruch
Toilette.
Schmelzpunkt
552 ºC (1.026 ºF, 825 K).
Siedepunkt
1.256 ºC (2.309 ºF, 1.538 K).
Wasserlöslichkeit
166,7 g / 100 ml bei 20 ° C. Beachten Sie die hohe Löslichkeit.
Löslichkeit in organischen Lösungsmitteln
Löslich in Methanol, Ethanol, Ether und Aceton. In Pyridin, einer aromatischen Verbindung, weniger löslich und weniger polar als die vorherigen.
Brechungsindex (ηD)
1.784.
Kalorienkapazität
51,88 J / mol K..
Standard molare Entropie (S.θ 298)
66,9 J / mol K..
Zündpunkt
1.265 ° C. Es gilt als nicht brennbar.
Stabilität
Stabil. Die wasserfreie Form ist jedoch extrem hygroskopisch.
Zersetzung
Beim Zersetzen durch Erhitzen entsteht Lithiumoxid.
pH
Zwischen pH 6 und 7 in wässriger Lösung (100 g / l, 20 ºC).
Reaktivität
Lithiumbromid ist unter normalen Umgebungsbedingungen nicht reaktiv. Mit steigender Temperatur können jedoch starke Reaktionen mit starken Säuren auftreten..
Beim Auflösen in Wasser steigt die Temperatur an, was durch eine negative Hydratationsenthalpie verursacht wird.
Produktion
LiBr wird hergestellt, indem Lithiumhydroxid oder Lithiumcarbonat mit Bromwasserstoffsäure in einer Neutralisationsreaktion umgesetzt werden:
LizweiCO3 + HBr => LiBr + COzwei + H.zweiODER
Lithiumbromid wird als Hydrat erhalten. Um die wasserfreie Form zu erhalten, muss das hydratisierte Salz unter Vakuum erhitzt werden..
Nomenklatur
Der Name "Lithiumbromid" leitet sich von der Tatsache ab, dass es sich um ein Metallhalogenid handelt, das gemäß der Bestandsnomenklatur so benannt wurde. Andere Namen, die gleichermaßen gültig sind, aber weniger verwendet werden, sind Lithiummonobromid gemäß der systematischen Nomenklatur; und lithisches Bromid (die einzigartige Wertigkeit von +1 für Lithium) gemäß der traditionellen Nomenklatur.
Anwendungen
Trockenmittel
LiBr ist ein hygroskopisches Salz, das eine konzentrierte Salzlösung bildet, die über einen weiten Temperaturbereich Feuchtigkeit aus der Luft aufnehmen kann. Diese Sole wird als Trockenmittel in Klima- und Kühlsystemen verwendet..
Fasern
Es wird verwendet, um das Volumen von Wolle, Haaren und anderen organischen Fasern zu erhöhen.
Pharmazeutische Addukte
LiBr bildet mit einigen pharmazeutischen Verbindungen Addukte, die ihre Wirkung modulieren. Ein Addukt ist die Kombination durch Koordination von zwei oder mehr Molekülen, ohne eine strukturelle Veränderung eines der verbundenen Moleküle hervorzurufen.
Beruhigungsmittel
Lithiumbromid wurde erstmals als Beruhigungsmittel bei bestimmten psychischen Störungen verwendet und 1940 abgesetzt. Derzeit wird Lithiumcarbonat verwendet. In jedem Fall ist Lithium das Element, das die therapeutische Wirkung in beiden Verbindungen ausübt.
Lithium wird zur Behandlung von bipolaren Störungen verwendet, da es bei der Kontrolle von manischen Episoden der Störung nützlich war. Es wird angenommen, dass Lithium die Aktivität von exzitatorischen Neurotransmittern wie Dopamin und Glutaminsäure hemmt.
Andererseits erhöht es die Aktivität des durch den Neurotransmitter Gamma-Amino-Buttersäure (GABA) vermittelten Hemmsystems. Diese Wirkungen könnten Teil der Grundlage der therapeutischen Wirkung von Lithium sein.
Risiken
Kontakttoxizität
Hautreizung und Sensibilisierung, Allergien. Schwere Augenschäden oder Reizungen der Augen, Atemwege, Nasenwege und des Rachens.
Verschlucken
Die Hauptsymptome aufgrund der Einnahme von Lithiumbromid sind: Magen-Darm-Störungen, Erbrechen und Übelkeit. Andere nachteilige Auswirkungen der Einnahme von Salz sind Unruhe, Krämpfe und Bewusstlosigkeit..
Der als "Bromismus" bekannte Zustand kann bei Lithiumbromid-Dosen von mehr als 225 mg / Tag auftreten..
Einige der folgenden Anzeichen und Symptome können bei Witzen auftreten: Akne-Exazerbation und Appetitlosigkeit, Zittern, Sprachprobleme, Apathie, Schwäche und manische Erregung.
Verweise
- Chemische Formulierung. (2019). Lithiumbromid. Wiederhergestellt von: formulacionquimica.com
- David C. Johnson. (10. Juli 2008). Neue Bestellung für Lithiumbromid. Natur. doi.org/10.1038/454174a
- Aayushi Jain & R.C. Dixit. (s.f.). Strukturphasenübergang in Lithiumbromid: Einfluss von Druck und Temperatur. [PDF]. Wiederhergestellt von: ncpcm.in
- Takamuku et al. (1997). Röntgenbeugungsstudien an unterkühlten wässrigen Lithiumbromid- und Lithiumiodidlösungen. Institut für Chemie, Fakultät für Naturwissenschaften, Fukuoka-Universität, Nanakuma, Jonan-ku, Fukuoka 814-80, Japan.
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Lithiumbromid. PubChem-Datenbank, CID = 82050. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Lithiumbromid. Wiederhergestellt von: en.wikipedia.org
- Royal Society of Chemistry. (2019). Lithiumbromid. Chemspider. Wiederhergestellt von: chemspider.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.