
Benzylbenzylwasserstoffe, Carbokationen, Benzylradikale
Das Benzyl oder Benzyl ist eine übliche Substituentengruppe in der organischen Chemie, deren Formel C ist6H.5CHzwei- oder Bn-. Strukturell besteht es einfach aus der Vereinigung einer Methylengruppe, CHzwei, mit einer Phenylgruppe, C.6H.5;; das heißt, ein Kohlenstoff sp3 direkt an einen Benzolring gebunden.
Daher kann die Benzylgruppe als ein aromatischer Ring angesehen werden, der an eine kleine Kette gebunden ist. In einigen Texten wird die Verwendung der Abkürzung Bn anstelle von C bevorzugt6H.5CHzwei-, in jeder Verbindung leicht zu erkennen sein; insbesondere wenn es an ein Sauerstoff- oder Stickstoffatom, O-Bn oder NBn gebunden istzwei, beziehungsweise.

Diese Gruppe findet sich auch implizit in einer Reihe weithin bekannter Verbindungen. Zum Beispiel zu Benzoesäure, C.6H.5COOH könnte als Benzyl angesehen werden, dessen Kohlenstoff sp3 es hat eine ausgedehnte Oxidation erfahren; oder Benzaldehyd, C.6H.5CHO aus einer partiellen Oxidation; und Benzylalkohol, C.6H.5CHzweiOH, noch weniger rostig.
Ein weiteres etwas offensichtliches Beispiel für diese Gruppe findet sich in Toluol, C.6H.5CH3, die aufgrund der ungewöhnlichen Stabilität aufgrund von Benzylradikalen oder Carbokationen eine bestimmte Anzahl von Reaktionen eingehen können. Die Benzylgruppe dient jedoch zum Schutz der OH- oder NH-Gruppen.zwei von Reaktionen, die das zu synthetisierende Produkt unerwünscht modifizieren.
Artikelverzeichnis
- 1 Beispiele für Verbindungen mit Benzylgruppe
- 2 Benzylwasserstoffe
- 3 Carbokationen und Benzylradikale
- 3.1 Resonanz in der Benzylgruppe
- 3.2 Andere Radikale
- 4 Reaktionen
- 5 Referenzen
Beispiele für Verbindungen mit Benzylgruppe
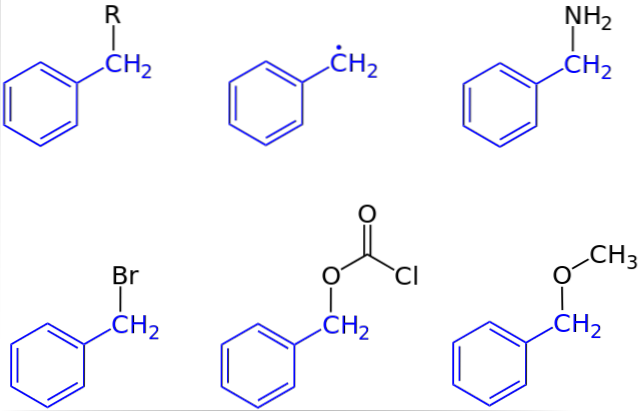
Im ersten Bild wurde die allgemeine Darstellung einer Verbindung mit einer Benzylgruppe gezeigt: C.6H.5CHzwei-R, wobei R ein beliebiges anderes Molekülfragment oder Atom sein kann. Somit kann durch Variieren von R eine hohe Anzahl von Beispielen erhalten werden; einige einfach, andere nur für einen bestimmten Bereich einer größeren Struktur oder Menge.
Benzylalkohol wird beispielsweise durch Ersetzen von R: C durch OH abgeleitet6H.5CHzwei-OH. Wenn es anstelle von OH die NH-Gruppe istzwei, dann entsteht die Benzylaminverbindung: C.6H.5CHzwei-NHzwei.
Wenn Br das Atom ist, das R ersetzt, ist die resultierende Verbindung Benzylbromid: C.6H.5CHzwei-Br; R für COzweiCl führt zu einem Ester, Benzylchlorcarbonat (oder Carbobenzoxylchlorid); und OCH3 führt zu Benzylmethylether, C.6H.5CHzwei-OCH3.
Auch (wenn auch nicht ganz richtig) kann R von einem einzelnen Elektron angenommen werden: dem Benzylradikal C.6H.5CHzwei·, Produkt der Freisetzung des Radikals R ·. Ein anderes Beispiel, obwohl nicht im Bild enthalten, ist Phenylacetonitril oder Benzylcyanid, C.6H.5CHzwei-CN.
Es gibt Verbindungen, bei denen die Benzylgruppe kaum eine bestimmte Region darstellt. In diesem Fall wird häufig die Abkürzung Bn verwendet, um die Struktur und ihre Darstellungen zu vereinfachen..
Benzylwasserstoffe
Die obigen Verbindungen haben nicht nur den aromatischen oder Phenylring gemeinsam, sondern auch benzylische Wasserstoffatome; Dies sind diejenigen, die zum sp-Kohlenstoff gehören3.
Solche Wasserstoffatome können dargestellt werden als: Bn-CH3, Bn-CHzweiR oder Bn-CHRzwei. Die Bn-CR-Verbindung3 Es fehlt Benzylwasserstoff, und daher ist seine Reaktivität geringer als die der anderen.
Diese Wasserstoffatome unterscheiden sich von denen, die normalerweise an einen sp-Kohlenstoff gebunden sind3.
Betrachten Sie zum Beispiel Methan, CH4, was auch als CH geschrieben werden kann3-H. Damit die CH-Bindung bricht3-H Bei einem heterolytischen Abbau (Radikalbildung) muss eine bestimmte Energiemenge zugeführt werden (104 kJ / mol)..
Die Energie für die gleiche C-Bindung bricht jedoch6H.5CHzwei-H ist niedriger als Methan (85 kJ / mol). Da diese Energie geringer ist, impliziert dies, dass das Radikal C.6H.5CHzweiEs ist stabiler als CH3·. Das gleiche passiert mehr oder weniger stark mit anderen benzylischen Wasserstoffatomen.
Folglich sind Benzylwasserstoffe reaktiver bei der Erzeugung stabilerer Radikale oder Carbokationen als diejenigen, die durch andere Wasserstoffatome verursacht werden. Warum? Die Frage wird im nächsten Abschnitt beantwortet.
Carbokationen und Benzylradikale
Das Radikal C wurde bereits berücksichtigt6H.5CHzwei· Fehlen der Benzylcarbokation: C.6H.5CHzwei+. Im ersten gibt es ein einzelnes ungepaartes Elektron und im zweiten einen elektronischen Mangel. Die beiden Spezies sind sehr reaktiv und stellen vorübergehende Verbindungen dar, aus denen die Endprodukte der Reaktion stammen..
Carbon sp3, Nach dem Verlust von ein oder zwei Elektronen zur Bildung des Radikals bzw. der Carbokation kann es eine sp-Hybridisierung annehmenzwei (trigonale Ebene), so dass es eine möglichst geringe Abstoßung zwischen seinen elektronischen Gruppen gibt. Aber wenn es sp istzwei, Kann wie bei den aromatischen Ringkohlenstoffen eine Konjugation auftreten? Die Antwort ist ja.
Resonanz in der Benzylgruppe
Diese Konjugation oder Resonanz ist der Schlüsselfaktor zur Erklärung der Stabilität dieser Benzyl- oder Benzyl-abgeleiteten Spezies. Das folgende Bild zeigt ein solches Phänomen:
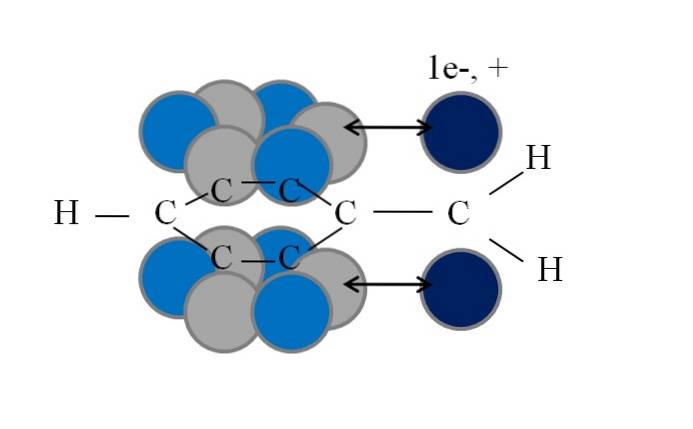
Es ist zu beachten, dass dort, wo sich einer der benzylischen Wasserstoffatome befand, ein Orbital verblieb p mit einem ungepaarten Elektron (Radikal, 1e-) oder nichtig (Carbokation, +). Wie zu sehen ist, ist dieses Orbital p ist parallel zum aromatischen System (die grauen und hellblauen Kreise), wobei der Doppelpfeil den Beginn der Konjugation anzeigt.
Somit können sowohl das ungepaarte Elektron als auch die positive Ladung durch den aromatischen Ring übertragen oder dispergiert werden, da die Parallelität ihrer Orbitale ihn geometrisch begünstigt. Diese liegen jedoch nicht in einem Orbital p aromatischer Ring; nur in jenen, die zu den Kohlenstoffen in ortho- und para-Positionen in Bezug auf CH gehörenzwei.
Deshalb heben sich die hellblauen Kreise von den grauen ab: In ihnen konzentriert sich die negative oder positive Dichte des Radikals bzw. der Carbokation..
Andere Radikale
Es sollte erwähnt werden, dass diese Konjugation oder Resonanz in sp-Kohlenstoffen nicht auftreten kann3 am weitesten vom aromatischen Ring entfernt.
Zum Beispiel das Radikal C.6H.5CHzweiCHzweiEs ist viel instabiler, weil das ungepaarte Elektron nicht mit dem Ring konjugieren kann, wenn die CH-Gruppe interveniertzwei dazwischen und mit sp-Hybridisierung3. Gleiches gilt für C.6H.5CHzweiCHzwei+.
Reaktionen
Zusammenfassend: Benzylwasserstoffe neigen zur Reaktion und erzeugen entweder ein Radikal oder ein Carbokation, was wiederum das Endprodukt der Reaktion verursacht. Sie reagieren daher über einen SN-Mechanismus.1.
Ein Beispiel ist die Bromierung von Toluol unter ultravioletter Strahlung:
C.6H.5CH3 + 1 / 2Brzwei => C.6H.5CHzweiBr
C.6H.5CHzweiBr + 1 / 2Brzwei => C.6H.5CHBrzwei
C.6H.5CHBrzwei + 1 / 2Brzwei => C.6H.5CBr3
Tatsächlich werden bei dieser Reaktion Br-Radikale erzeugt..
Andererseits reagiert die Benzylgruppe selbst, um die OH- oder NH-Gruppen zu schützen.zwei in einer einfachen Substitutionsreaktion. Somit kann ein ROH-Alkohol unter Verwendung von Benzylbromid und anderen Reagenzien (KOH oder NaH) "benzyliert" werden:
ROH + BnBr => ROBn + HBr
ROBn ist ein Benzylether, zu dem seine anfängliche OH-Gruppe zurückgeführt werden kann, wenn er einem reduktiven Medium ausgesetzt wird. Dieser Ether sollte unverändert bleiben, während andere Reaktionen an der Verbindung durchgeführt werden..
Verweise
- Morrison, R.T. und Boyd, R. N. (1987). Organische Chemie. (5. Auflage). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Organische Chemie. (6. Auflage). McGraw-Hill, Interamerica, Herausgeber S.A..
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10. Auflage). Wiley plus.
- Wikipedia. (2019). Benzylgruppe. Wiederhergestellt von: en.wikipedia.org
- Dr. Donald L. Robertson. (5. Dezember 2010). Phenyl oder Benzyl? Wiederhergestellt von: home.miracosta.edu
- Gamini Gunawardena. (2015, 12. Oktober). Benzylcarbokation. Chemie LibreTexts. Wiederhergestellt von: chem.libretexts.org



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.