
Aminstruktur, Eigenschaften, Typen, Verwendungen, Beispiele
Das Amine Sie sind organische Verbindungen, die von Ammoniak abgeleitet sind. In ihnen gibt es kovalente Bindungen zwischen Kohlenstoff und Stickstoff. Natürlich ist das Stickstoffmolekül kinetisch inert; Dank der biologischen Fixierung wird es jedoch in Ammoniak umgewandelt, das wiederum nachfolgende Alkylierungsreaktionen eingeht.
Wenn Ammoniak "alkyliert" ist, ersetzt es einen, zwei oder drei seiner drei Wasserstoffatome durch Kohlenstoffatome. Diese Kohlenstoffe können durchaus von einer Alkyl (R) - oder Aryl (Ar) -Gruppe stammen. Somit gibt es aliphatische Amine (linear oder verzweigt) und aromatische.

Die allgemeine Formel für aliphatische Amine ist oben gezeigt. Diese Formel kann für aromatische Amine verwendet werden, wenn man bedenkt, dass R auch eine Arylgruppe Ar sein kann. Beachten Sie die Ähnlichkeit zwischen Amin und Ammoniak, NH3. Praktisch wurde ein H durch eine R-Seitenkette ersetzt.
Wenn R aus aliphatischen Ketten besteht, haben Sie ein sogenanntes Alkylamin; während, wenn R von Natur aus aromatisch ist, ein Arylamin. Von den Arylaminen ist Alanin das wichtigste: eine Aminogruppe, -NHzwei, an den Benzolring gebunden.
Wenn eine Molekülstruktur sauerstoffhaltige Gruppen wie OH und COOH enthält, wird die Verbindung nicht mehr als Amin bezeichnet. In diesem Fall wird das Amin als Substituent angesehen: die Aminogruppe. Dies tritt beispielsweise in Aminosäuren sowie in anderen Biomolekülen auf, die für das Leben von enormer Bedeutung sind..
Da Stickstoff in vielen lebenswichtigen Verbindungen enthalten ist, wurden diese als lebenswichtige Amine angesehen. dh "Vitamine". Viele der Vitamine sind jedoch nicht einmal Amine, und außerdem sind nicht alle lebenswichtig. Dies negiert jedoch nicht seine große Bedeutung in lebenden Organismen..
Amine sind stärkere organische Basen als Ammoniak selbst. Sie sind leicht aus Pflanzenmaterial extrahierbar und haben im Allgemeinen starke Wechselwirkungen mit der neuronalen Matrix von Organismen; Daher bestehen viele Arzneimittel und Arzneimittel aus Aminen mit komplexen Strukturen und Substituenten.
Artikelverzeichnis
- 1 Struktur
- 2 Eigenschaften von Aminen
- 2.1 Polarität
- 2.2 Physikalische Eigenschaften
- 2.3 Löslichkeit in Wasser
- 2.4 Basizität
- 3 Typen (primär, sekundär, tertiär)
- 4 Schulung
- 4.1 Alkylierung von Ammoniak
- 4.2 Katalytische Hydrierung
- 5 Nomenklatur
- 6 Verwendungen
- 6.1 Farbstoffe
- 6.2 Drogen und Drogen
- 6.3 Gasbehandlung
- 6.4 Agrarchemie
- 6.5 Herstellung von Harzen
- 6.6 Tierische Nährstoffe
- 6.7 Gummiindustrie
- 6.8 Lösungsmittel
- 7 Beispiele
- 7.1 Kokain
- 7.2 Nikotin
- 7.3 Morphin
- 7.4 Serotonin
- 8 Referenzen
Struktur
Wie ist ihre Struktur? Obwohl es je nach Art von R variiert, ist die elektronische Umgebung des Stickstoffatoms für alle gleich: tetraedrisch. Da sich jedoch ein Paar ungeteilter Elektronen am Stickstoffatom befindet (··), wird die Molekülgeometrie pyramidenförmig. Dies ist bei Ammoniak und Aminen der Fall.
Amine können wie Kohlenstoffverbindungen durch ein Tetraeder dargestellt werden. Somit ist NH3 und CH4 werden als Tetraeder gezeichnet, wobei sich das Paar (··) an einem der Eckpunkte über dem Stickstoff befindet.
Beide Moleküle sind achiral; Sie beginnen jedoch, Chiralität zu präsentieren, wenn ihre Hs durch R ersetzt werden. Das Amin R.zweiNH ist achiral, wenn die beiden Rs unterschiedlich sind. Es fehlt jedoch jede Konfiguration, um ein Enantiomer von einem anderen zu unterscheiden (wie dies bei chiralen Kohlenstoffzentren der Fall ist)..
Dies liegt daran, dass die Enantiomere:
R.zweiN-H | H-NRzwei
sie werden mit einer solchen Geschwindigkeit ausgetauscht, dass keiner von ihnen sich isolieren kann; und daher werden die Strukturen von Aminen als achiral angesehen, obwohl alle Substituenten am Stickstoffatom unterschiedlich sind.
Eigenschaften von Aminen
Polarität
Amine sind polare Verbindungen, da die Aminogruppe NHzwei, Durch ein elektronegatives Stickstoffatom trägt es zum Dipolmoment des Moleküls bei. Es ist zu beachten, dass Stickstoff die Fähigkeit besitzt, Wasserstoffbrückenbindungen abzugeben, was dazu führt, dass Amine im Allgemeinen hohe Siede- und Schmelzpunkte aufweisen..
Wenn diese Eigenschaft jedoch mit der von sauerstoffhaltigen Verbindungen wie Alkoholen und Carbonsäuren verglichen wird, führen sie zu geringeren Größen..
Zum Beispiel ist der Siedepunkt von Ethylamin, CH3CHzweiNHzwei (16,6 ° C) ist niedriger als die von Ethanol, CH3CHzweiOH (78ºC).
Somit wird gezeigt, dass O-H-Wasserstoffbrückenbindungen stärker sind als die von N-H, obwohl ein Amin mehr als eine Brücke bilden kann. Dieser Vergleich ist nur gültig, wenn R für die beiden Verbindungen (CH) das gleiche Molekulargewicht hat3CHzwei-). Andererseits siedet Ethan bei -89ºC, CH3CH3, ein Gas bei Raumtemperatur sein.
Da ein Amin weniger Wasserstoff hat, bildet es weniger Wasserstoffbrücken und sein Siedepunkt wird gesenkt. Dies wird durch Vergleichen des Siedepunkts von Dimethylamin (CH) gesehen3)zweiNH (7ºC), mit dem von Ethylamin (16,6ºC).
Physikalische Eigenschaften
Wenn Sie in der Welt der Chemie von einem Amin sprechen, entsteht der unwillkürliche Akt, Ihre Nase zu halten. Dies liegt daran, dass sie im Allgemeinen unangenehme Gerüche haben, von denen einige denen von faulen Fischen ähneln..
Darüber hinaus neigen flüssige Amine dazu, gelbliche Töne zu haben, was das visuelle Misstrauen erhöht, das sie erzeugen..
Wasserlöslichkeit
Amine neigen dazu, in Wasser unlöslich zu sein, weil sie mit H Wasserstoffbrückenbindungen eingehen könnenzweiOder seine organische Hauptkomponente ist hydrophob. Je größer oder länger die R-Gruppen sind, desto geringer ist ihre Löslichkeit in Wasser..
Wenn sich jedoch eine Säure im Medium befindet, wird die Löslichkeit durch die Bildung von sogenannten Aminsalzen erhöht. In ihnen hat Stickstoff eine positive Teilladung, die das Anion oder die konjugierte Base der Säure elektrostatisch anzieht..
Zum Beispiel in einer verdünnten Lösung von HCl das Amin RNHzwei reagiert wie folgt:
RNHzwei + HCl => RNH3+Cl- (primäres Aminsalz)
RNHzwei Es war in Wasser unlöslich (oder schwer löslich) und bildet in Gegenwart der Säure ein Salz, dessen Solvatisierung seiner Ionen seine Löslichkeit begünstigt.
Warum passiert das? Die Antwort liegt in einer der Haupteigenschaften von Aminen: Sie sind polar und basisch. Da sie basisch sind, reagieren sie mit Säuren, die stark genug sind, um sie gemäß der Brönsted-Lowry-Definition zu protonieren..
Basizität
Amine sind stärkere organische Basen als Ammoniak. Je höher die Elektronendichte um das Stickstoffatom ist, desto basischer wird es sein; Das heißt, es deprotoniert die Säuren in der Umwelt schneller. Wenn das Amin sehr basisch ist, kann es sogar das Proton von Alkoholen stehlen.
Die R-Gruppen tragen durch induktiven Effekt zur Elektronendichte zum Stickstoff bei; denn wir dürfen nicht vergessen, dass es eines der elektronegativsten Atome ist, die es gibt. Wenn diese Gruppen sehr lang oder sperrig sind, ist der induktive Effekt größer, wodurch auch der negative Bereich um das Elektronenpaar (··) vergrößert wird..
Dies führt dazu, dass (··) das H-Ion schneller akzeptiert+. Wenn R jedoch sehr sperrig ist, nimmt die Basizität aufgrund des sterischen Effekts ab. Warum? Aus dem einfachen Grund, dass der H.+ muss eine Konfiguration von Atomen kreuzen, bevor Stickstoff erreicht wird.
Eine andere Möglichkeit, über die Basizität eines Amins nachzudenken, besteht darin, sein Aminsalz zu stabilisieren. Nun kann derjenige, der durch induktiven Effekt abnimmt, die positive Ladung N verringern+, Es wird ein grundlegenderes Amin sein. Die Gründe sind die gleichen, die gerade erklärt wurden.
Alkylamine gegen Arylamine
Alkylamine sind viel basischer als Arylamine. Warum? Um es einfach zu verstehen, wird die Struktur von Anilin gezeigt:
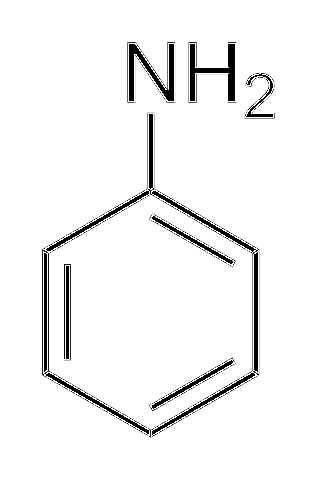
Oben in der Aminogruppe befindet sich das Elektronenpaar (··). Dieses Paar "bewegt" sich innerhalb des Rings in ortho- und para-Position in Bezug auf NHzwei. Dies bedeutet, dass die beiden oberen Eckpunkte und das Gegenteil von NHzwei sind negativ geladen, während das Stickstoffatom positiv ist.
Da der Stickstoff positiv geladen ist, +N stößt das H-Ion ab+. Und wenn dies nicht ausreicht, wird das Elektronenpaar innerhalb des aromatischen Rings delokalisiert, wodurch es für Deprotonatsäuren weniger zugänglich ist..
Die Basizität von Anilin kann zunehmen, wenn Gruppen oder Atome, die ihm elektronische Dichte verleihen, an den Ring gebunden sind, mit dem Paar (··) konkurrieren und es zwingen, sich mit größerer Wahrscheinlichkeit auf dem Stickstoffatom zu befinden, das bereit ist, als Base zu wirken.
Typen (primär, sekundär, tertiär)

Obwohl nicht offiziell dargestellt, wurde implizit auf primäre, sekundäre und tertiäre Amine Bezug genommen (oberes Bild, von links nach rechts).
Primäre Amine (RNHzwei) sind die monosubstituierten; die sekundären (R.zweiNH) mit zwei R-Alkyl- oder Arylgruppen disubstituiert sind; und die tertiären (R.3N) sind trisubstituiert und es fehlt Wasserstoff.
Alle vorhandenen Amine stammen von diesen drei Typen, so dass ihre Vielfalt und Wechselwirkungen mit der biologischen und neuronalen Matrix enorm sind.
Im Allgemeinen könnte erwartet werden, dass tertiäre Amine die basischsten sind; Eine solche Aussage kann jedoch nicht gemacht werden, ohne die Strukturen von R zu kennen.
Ausbildung
Ammoniakalkylierung
Zunächst wurde erwähnt, dass Amine aus Ammoniak gewonnen werden; Daher ist der einfachste Weg, sie zu bilden, die Alkylierung. Zu diesem Zweck wird ein Überschuss an Ammoniak mit einem Alkylhalogenid umgesetzt, gefolgt von der Zugabe einer Base, um das Aminsalz zu neutralisieren:
NH3 + RX => RNH3+X.- => RNHzwei
Beachten Sie, dass diese Schritte zu einem primären Amin führen. Es können auch sekundäre und sogar tertiäre Amine gebildet werden, so dass die Ausbeute für ein einzelnes Produkt abnimmt.
Einige Trainingsmethoden, wie die Gabriel-Synthese, ermöglichen es, primäre Amine zu erhalten, so dass keine anderen unerwünschten Produkte gebildet werden.
Auch Ketone und Aldehyde können in Gegenwart von Ammoniak und primären Aminen reduziert werden, um sekundäre und tertiäre Amine zu erzeugen..
Katalytische Hydrierung
Nitroverbindungen können in Gegenwart von Wasserstoff und einem Katalysator zu ihren entsprechenden Aminen reduziert werden.
ArNOzwei => ArNHzwei
Nitrile, RC≡N und Amide, RCONRzwei, werden auch reduziert, um primäre bzw. tertiäre Amine zu ergeben.
Nomenklatur
Wie heißen Amine? Meistens werden sie nach R, der Alkyl- oder Arylgruppe, benannt. Zum Namen von R, abgeleitet von seinem Alkan, wird am Ende das Wort "Amin" hinzugefügt.
Somit ist CH3CHzweiCHzweiNHzwei ist Propylamin. Andererseits kann es nur unter Berücksichtigung des Alkans und nicht als R-Gruppe benannt werden: Propanamin.
Die erste Art, sie zu benennen, ist bei weitem die bekannteste und am häufigsten verwendete.
Wenn es zwei NH-Gruppen gibtzwei, Das Alkan wird benannt und die Positionen der Aminogruppen werden aufgelistet. So ist die H.zweiNCHzweiCHzweiCHzweiCHzweiNHzwei heißt: 1,4-Butandiamin.
Wenn es sauerstoffhaltige Gruppen wie OH gibt, sollte dies Vorrang vor NH habenzwei, was zufällig als Substituent benannt wird. Zum Beispiel HOCHzweiCHzweiCHzweiNHzwei Es heißt: 3-Aminopropanol.
Und in Bezug auf sekundäre und tertiäre Amine werden die Buchstaben N verwendet, um die R-Gruppen anzuzeigen. Die längste Kette bleibt beim Namen der Verbindung. So ist die ch3NHCHzweiCH3 Es heißt: N-Methylethylamin.
Anwendungen
Farbstoffe
Primäre aromatische Amine können als Ausgangsmaterial für die Azofarbstoffsynthese dienen. Amine reagieren zunächst unter Bildung von Diazoniumsalzen, die durch Azokupplung (oder Diazokupplung) Azoverbindungen bilden..
Diese werden aufgrund ihrer intensiven Färbung in der Textilindustrie als Färbematerial eingesetzt; Zum Beispiel: Methylorange, direktes Braun 138, sonnenuntergangsgelbes FCF und Ponceau.
Drogen und Drogen
Viele Medikamente wirken mit Agonisten und Antagonisten natürlicher Amin-Neurotransmitter. Beispiele:
-Chlorpheniramin ist ein Antihistaminikum, das zur Kontrolle allergischer Prozesse aufgrund der Einnahme einiger Lebensmittel, Heuschnupfen, Insektenstichen usw. verwendet wird..
-Chlorpromazin ist ein Beruhigungsmittel, kein Schlafmittel. Lindert Angstzustände und wird sogar zur Behandlung einiger psychischer Störungen eingesetzt.
-Ephedrin und Phenylephedrin werden als abschwellende Mittel für die Atemwege verwendet.
-Amitriptylin und Imipramin sind tertiäre Amine, die bei der Behandlung von Depressionen eingesetzt werden. Aufgrund ihrer Struktur werden sie als trizyklische Antidepressiva eingestuft..
-Opioid-Schmerzmittel wie Morphin, Codeline und Heroin sind tertiäre Amine.
Gasbehandlung
Bei der Eliminierung von Kohlendioxid (CO) werden verschiedene Amine verwendet, darunter Diglycolamin (DGA) und Diethanolamin (DEA)zwei) und Schwefelwasserstoff (H.zweiS) in Erdgas und Raffinerien vorhanden.
Agrarchemie
Methylamine sind Zwischenverbindungen bei der Synthese von Chemikalien, die in der Landwirtschaft als Herbizide, Fungizide, Insektizide und Biozide verwendet werden.
Harzherstellung
Methylamine werden bei der Herstellung von Ionenaustauscherharzen verwendet, die bei der Deionisierung von Wasser verwendet werden können.
Tierische Nährstoffe
Trimethylamin (TMA) wird hauptsächlich zur Herstellung von Cholinchlorid verwendet, einem Vitamin B-Präparat, das zur Fütterung von Hühnern, Puten und Schweinen verwendet wird..
Gummiindustrie
Dimethylaminoleat (DMA) ist ein Emulgator zur Herstellung von Synthesekautschuk. DMA wird direkt als Polymerisationsmodifikator in der Dampfphase von Butadien und als Stabilisator für Naturkautschuklatex anstelle von Ammoniak verwendet
Lösungsmittel
Dimethylamin (DMA) und Monomethylamin (MMA) werden zur Synthese der aprotischen polaren Lösungsmittel Dimethylformamid (DMF), Dimethylacetamid (DMAc) und n-Methylpyrrolidon (NMP) verwendet..
Anwendungen für DMF umfassen: Urethanbeschichtung, Acrylgarnlösungsmittel, Reaktionslösungsmittel und Extraktionslösungsmittel.
DMAc wird zur Herstellung von Garnfarbstoffen und Lösungsmitteln verwendet. Schließlich wird NMP zum Raffinieren von Schmierölen, Abbeizmitteln und Emailbeschichtungen verwendet..
Beispiele
Kokain
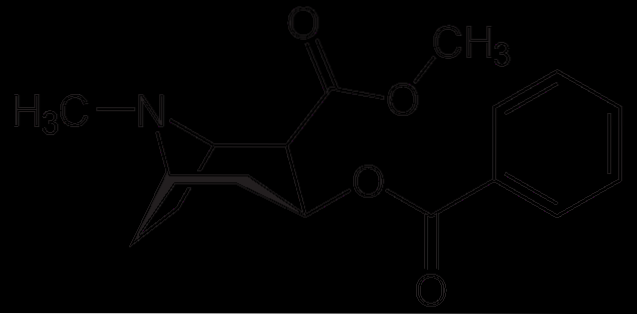
Kokain wird als Lokalanästhetikum bei bestimmten Arten von Augen-, Ohren- und Rachenoperationen eingesetzt. Wie zu sehen ist, ist es ein tertiäres Amin.
Nikotin

Nikotin ist der Hauptwirkstoff der Tabaksucht und chemisch ein tertiäres Amin. Das Nikotin im Tabakrauch zieht schnell ein und ist hochgiftig.
Morphium
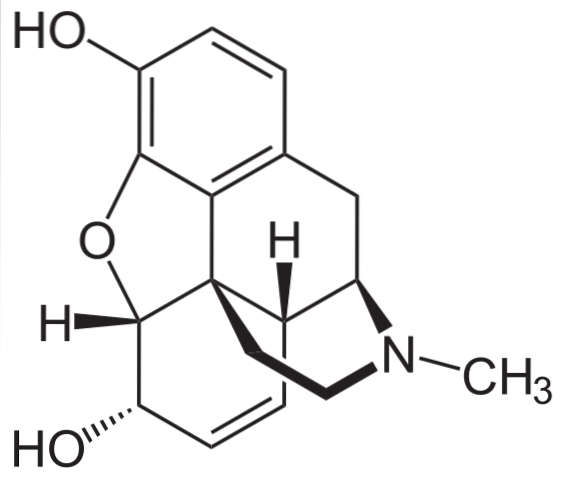
Es ist eines der wirksamsten Schmerzmittel zur Schmerzlinderung, insbesondere bei Krebs. Es ist wieder ein tertiäres Amin.
Serotonin

Serotonin ist ein Amin-Neurotransmitter. Bei depressiven Patienten ist die Konzentration des Hauptmetaboliten von Serotonin verringert. Im Gegensatz zu den anderen Aminen ist dieses primär.
Verweise
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10th Auflage.). Wiley plus.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Morrison und Boyd. (1987). Organische Chemie. (Fünfte Ausgabe). Addison-Wesley Iberoamericana.
- Die Chemours Company. (2018). Methylamine: Verwendungen und Anwendungen. Wiederhergestellt von: chemours.com
- Marktforschung für Transparenz. (s.f.). Amine: wichtige Fakten und Verwendungen. Wiederhergestellt von: transparencymarketresearch.com
- Wikipedia. (2019). Amin. Wiederhergestellt von: en.wikipedia.org
- Ganong, W. F. (2003). Medizinische Physiologie. 19. Auflage. Editorial Das moderne Handbuch.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.