
Struktur, Eigenschaften, Risiken und Verwendungen des tertiären Butylalkohols
Das tertiärer Butylalkohol ist eine organische Verbindung mit der Formel (CH3)3COH oder t-BuOH. Es ist der einfachste tertiäre Alkohol von allen. Je nach Umgebungstemperatur erscheint es als farbloser Feststoff oder Flüssigkeit. Das Bild unten zeigt zum Beispiel seine farblosen Kristalle.
Dieser Alkohol ist weder ein Substrat für das Enzym der alkoholischen Dehydrogenase noch für die Peroxidaseaktivität der Katalase, daher wird er als nicht metabolisierbarer Alkohol eingestuft. Aufgrund seiner biochemischen Eigenschaften wird angenommen, dass es beim Nachweis von Hydroxylradikalen in vivo in intakten Zellen nützlich sein könnte..

Es ist eines der vier Isomere von Isobutylalkohol, wobei das Isomer am wenigsten oxidationsanfällig und am wenigsten reaktiv ist. In der Natur kommt es in Kichererbsen und Maniok oder Maniok vor, einer Wurzel, die fermentiert wird, um alkoholische Getränke herzustellen..
Tertiärer Butylalkohol ist in Wasser und organischen Lösungsmitteln sehr gut löslich. Seine Hauptverwendung ist als Lösungsmittel, das diese Rolle bei der Herstellung von Kunststoffen, Parfums, Farbentfernern usw. erfüllt..
Wie viele organische Verbindungen ist es ein bisschen giftig, aber in hohen Dosen hat es eine narkotische Wirkung, die durch Kopfschmerzen, Benommenheit, Schwindel, Schwindel und Benommenheit gekennzeichnet ist..
Artikelverzeichnis
- 1 Struktur von tert-Butylalkohol
- 2 Eigenschaften
- 2.1 Chemische Namen
- 2.2 Summenformel
- 2.3 Molekulargewicht
- 2.4 Physikalische Beschreibung
- 2.5 Geruch
- 2.6 Siedepunkt
- 2.7 Schmelzpunkt
- 2.8 Flammpunkt
- 2.9 Löslichkeit in Wasser
- 2.10 Löslichkeit in organischen Lösungsmitteln
- 2.11 Dichte
- 2.12 Dampfdichte
- 2.13 Dampfdruck
- 2.14 Octanol / Wasser-Verteilungskoeffizient
- 2.15 Thermostabilität
- 2.16 Selbstentzündungstemperatur
- 2.17 Zersetzung
- 2.18 Verdampfungswärme
- 2.19 Kalorienkapazität
- 2.20 Bildungsenthalpie
- 2.21 Lagertemperatur
- 2.22 Stabilität
- 2.23 Ionisationspotential
- 2.24 Geruchsschwelle
- 2.25 Brechungsindex
- 2.26 Dissoziationskonstante
- 2.27 Maximale Dampfkonzentration
- 2.28 Reaktionen
- 3 Risiken
- 4 Verwendungen
- 5 Referenzen
Struktur von tert-Butylalkohol
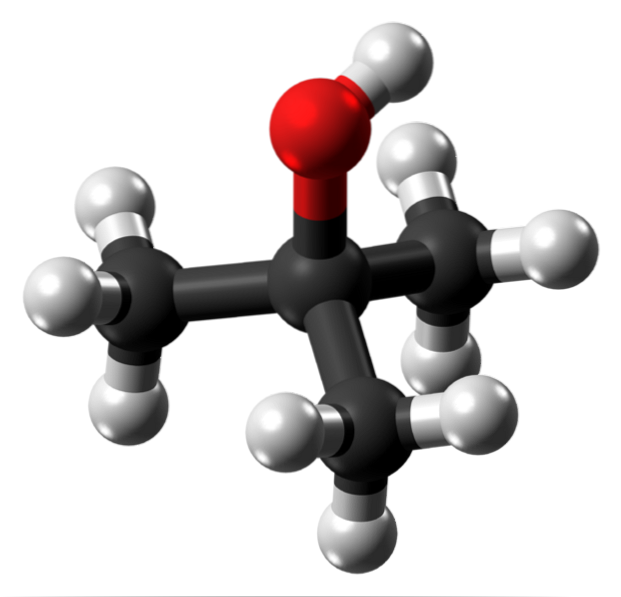
Das obere Bild zeigt die Molekülstruktur von tert-Butylalkohol mit einem Modell von Kugeln und Balken. Das gesamte Molekül hat eine globale tetraedrische Geometrie, wobei sich der 3. Kohlenstoff im Zentrum befindet und die CH-Gruppen3 und OH an seinen Eckpunkten.
Wenn man diese Struktur betrachtet, versteht man, warum dieser Alkohol tertiär ist: Der Kohlenstoff im Zentrum ist mit drei anderen Kohlenstoffen verbunden. Weiter mit dem Tetraeder kann der untere Teil davon als unpolar betrachtet werden, während sein oberer Scheitelpunkt polar ist.
An diesem Scheitelpunkt befindet sich die OH-Gruppe, die ein permanentes Dipolmoment erzeugt und es den t-BuOH-Molekülen ermöglicht, über Wasserstoffbrückenbindungen zu interagieren. genauso wie bei Wassermolekülen und anderen polaren Substanzen.
In t-BuOH-Kristallen sind diese Wasserstoffbrückenbindungen ein Schlüsselfaktor für das Zusammenbleiben der Moleküle. obwohl es nicht viele Informationen darüber gibt, wie die Kristallstruktur dieses Alkohols ist.
Da die OH-Gruppe so nah und von den unpolaren Gruppen CH umgeben ist3, Die Wassermoleküle können fast den gesamten Alkohol gleichzeitig mit der Wechselwirkung mit dem OH hydratisieren. Dies würde seine große Löslichkeit in Wasser erklären..
Eigenschaften
Chemische Namen
-Tertiärer Butylalkohol
-tert-Butanol
-2-Methyl-2-propanol
-2-Methylpropan-2-ol.
Molekularformel
C.4H.10O oder (CH3)3COH.
Molekulargewicht
74,123 g / mol.
Physische Beschreibung
Farbloser Feststoff oder farblose Flüssigkeit, abhängig von der Umgebungstemperatur, da der Schmelzpunkt 25,4 ° C beträgt. Oberhalb von 77,9ºF ist es eine Flüssigkeit.
Geruch
Ähnlich wie Kampfer.
Siedepunkt
82,4 ºC.
Schmelzpunkt
25,4 ºC (77,9 ºF).
Zündpunkt
11 ° C (52 ° F). Geschlossene Tasse.
Wasserlöslichkeit
Sehr löslich. Unabhängig von den Anteilen ist dieser Alkohol immer mit Wasser mischbar..
Löslichkeit in organischen Lösungsmitteln
Mit Ethanol, Ethylether mischbar und in Chloroform löslich.
Dichte
0,78 g / cm3.
Wasserdampfdichte
2,55 (relativ zu Luft = 1).
Dampfdruck
4,1 kPa bei 20 ºC.
Octanol / Wasser-Verteilungskoeffizient
Log P = 0,35.
Thermostabilität
In der Hitze instabil
Selbstentzündungstemperatur
470 ºC (896 ºF).
Zersetzung
Beim Erhitzen können Kohlenmonoxid- und Isobutylen-Dämpfe freigesetzt werden.
Verdampfungswärme
39,07 kJ / mol.
Kalorienkapazität
215,37 JK-1Maulwurf-1.
Bildungsenthalpie
-360,04 bis -358,36 kJmol-1.
Lagertemperatur
2-8 ºC.
Stabilität
Es ist stabil, aber nicht kompatibel mit starken Oxidationsmitteln, Kupfer, Kupferlegierungen, Alkalimetallen und Aluminium.
Ionisationspotential
9,70 eV.
Geruchsschwelle
219 mg / m3 (geruchsarm).
Brechungsindex
1.382 bei 25 ºC.
Dissoziationskonstante
pKa = 19,20.
Maximale Dampfkonzentration
5,53% bei 25 ºC.
Reaktionen
-Es wird durch eine starke Base deprotoniert, wodurch ein Alkoxidanion entsteht; speziell ein Terbutoxid (CH3)3CO-.
-Tertiärer Butylalkohol reagiert mit Chlorwasserstoff unter Bildung von tertiärem Butylchlorid..
(CH3)3COH + HCl => (CH3)3CCl + H.zweiODER
Tertiäre Alkohole reagieren mit Halogenwasserstoffen stärker als sekundäre und primäre Alkohole.
Risiken
Tert-Butylalkohol in Kontakt mit der Haut verursacht geringfügige Läsionen wie nicht schweres Erythem und Hyperämie. Es geht auch nicht durch die Haut. Im Gegenteil, in den Augen kommt es zu starken Reizungen.
Beim Einatmen reizt es Nase, Rachen und Bronchien. Bei hoher Exposition können Betäubungseffekte, ein schläfriger Zustand sowie Benommenheit, Benommenheit und Kopfschmerzen auftreten.
Dieser Alkohol ist ein experimentelles teratogenes Mittel, weshalb bei Tieren beobachtet wurde, dass er das Auftreten angeborener Störungen beeinflussen kann.
In Bezug auf seine Lagerung sind seine Flüssigkeiten und Dämpfe brennbar und können daher unter bestimmten Umständen Brände und Explosionen verursachen..
OSHA legte eine Konzentrationsgrenze von 100 ppm (300 mg / m) fest3) für eine 8-stündige Schicht.
Anwendungen
-Tert-Butylalkohol wird zum Einbau der tert-Butylgruppe in organische Verbindungen verwendet, um öllösliche Harze und Trinitro-tert-butyltoluol, einen künstlichen Moschus, herzustellen. Darüber hinaus bildet es ein Ausgangsmaterial für die Herstellung von Peroxiden.
-Es wurde von der FDA als Entschäumungsmittel für Kunststoffmaterialien und -komponenten zugelassen, die mit Lebensmitteln in Kontakt kommen. Es wurde zur Herstellung von Fruchtessenzen, Kunststoffen und Lacken verwendet.
-Es ist ein Zwischenprodukt zur Herstellung von tert-Butylchlorid und Tributylphenol. Wirkt als Denaturierungsmittel für Ethanol.
-Es wird zur Herstellung von Flotationsmitteln als organisches Lösungsmittel zur Entfernung von Farben und zum Auflösen von in Parfums verwendeten Essenzen verwendet..
-Es wird als Oktanverstärker in Benzin verwendet; Kraftstoff und Kraftstoffadditiv; Lösungsmittel zur Reinigung und als Entfetter.
-Tert-Butylalkohol ist ein Zwischenprodukt bei der Herstellung von tert-Butylmethylether (MTBE) und Tributylethylether (ETBE), die jeweils mit Methanol und Ethanol reagieren.
-In gleicher Weise wirkt es auch bei der Herstellung von Tributylhydroperoxid (TBHP) durch Reaktion mit Wasserstoffperoxid..
-Es wird als Reagenz in dem als Curtius-Umlagerung bekannten Verfahren verwendet..
Verweise
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10th Auflage.). Wiley plus.
- Wikipedia. (2019). Tert-Butylalkohol. Wiederhergestellt von: en.wikipedia.org
- CommonOrganicChemistry. (s.f.). t-Butanol. Wiederhergestellt von: commonorganicchemistry.com
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Tert Butanol. PubChem-Datenbank. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Carey F. A. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.