
Begründung, Vorbereitung und Verwendung von XLD-Agar
Das XLD-Agar oder Xylose-Lysin-Desoxycholat-Agar ist ein selektives und differenzielles festes Kulturmedium zur Isolierung von Enteropathogenen. Taylor entwarf die XL-Agarformel (Xylose, Lysin), um die Isolierung der Gattung Shigella zu verbessern.
Er beobachtete, dass diese Gattung in den meisten Medien, die zur Isolierung von Enteropathogenen bestimmt waren, gehemmt war. Anschließend wurden Natriumdesoxycholat, Natriumthiosulfat und Eisenammoniumcitrat zugegeben, um seine Selektivität zu erhöhen. Diese Formel hat sich sowohl für die Isolierung von Shigella als auch von Salmonella als nützlich erwiesen.
XLD-Agar besteht aus Hefeextrakt, Natriumdesoxycholat, Xylose, Lysin, Lactose, Saccharose, Natriumthiosulfat, Eisenammoniumcitrat, Natriumchlorid, Phenolrot und Agar. In den meisten bakteriologischen Labors werden Duo-XLD-Agar und SS-Agar verwendet, um Stuhlproben auf Shigella und Salmonella zu untersuchen..
Andere Labors bevorzugen unter anderem die Kombination von CHROMagar Salmonella und XLD-Agar. Diese Duos können in doppelten Petrischalen zubereitet werden. Auf der einen Seite platzieren sie XLD-Agar und auf der anderen Seite das andere gewählte Medium.
Artikelverzeichnis
- 1 Begründung
- 1.1 -Nutritive Kraft
- 1.2 -Selektivität des Mediums
- 1.3 -Differentialleistung
- 1,4-Natriumchlorid, Agar und Phenolrot
- 2 Vorbereitung
- 3 Verwendungen
- 3.1 Arten von Proben
- 3.2 Aussaat- und Identifikationsbedingungen
- 4 Qualitätskontrolle
- 5 Abschließende Überlegungen
- 6 Referenzen
Basis
-Nährende Kraft
XLD-Agar enthält Hefeextrakt, der als Nährstoffquelle für die Mikroorganismen dient, die sich auf diesem Agar entwickeln. Darüber hinaus liefert das Vorhandensein von Kohlenhydraten (Xylose, Saccharose und Lactose) Energie für die Bakterien, die sie fermentieren können.
-Selektivität des Mediums
Als hemmende Substanz enthält es Natriumdesoxycholat; Dies verhindert das Wachstum von grampositiven Bakterien und macht das Medium selektiv.
-Differenzleistung
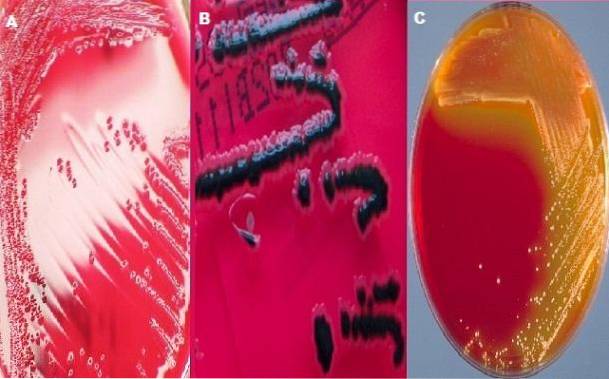
Typische Shigella-Kolonien
Wie bereits erwähnt, enthält XLD-Agar Xylose; Dieses Kohlenhydrat wird von allen Bakterien fermentiert, die in diesem Medium wachsen, mit Ausnahme der Gattung Shigella..
Dies ist eine der Eigenschaften, die ihm seinen unterschiedlichen Charakter verleihen, da sich die Shigella-Kolonien durch die Entwicklung roter Kolonien von den anderen unterscheiden, während die anderen Bakterien gelbe Kolonien produzieren.
Typische Kolonien von Salmonellen
Die Gattung Salmonella fermentiert auch Xylose und erzeugt zunächst gelbe Kolonien. Nach dem Abbau der Kohlenhydratxylose greift es jedoch Lysin wegen seines Enzyms Lysin-Decarboxylase an. Die Decarboxylierung von Lysin erzeugt Alkalien, die die Farbe der Kolonie und des umgebenden Mediums in das ursprüngliche Rot verwandeln.
Dieses Verhalten wird nur von Salmonellen durchgeführt, da die Coliformen, die Lysin decarboxylieren, das Medium nicht alkalisieren können. Dies liegt daran, dass Coliforme auch die vorhandene Laktose und Saccharose fermentieren; Daher ist die Produktion von Säuren sehr hoch, so dass die gelbe Kolonie in diesen Bakterien verbleibt.
Es ist zu beachten, dass die Gattung Salmonella weder Saccharose noch Lactose fermentiert.
Produktion von H.zweiS.
XLD-Agar ermöglicht auch den Nachweis von Salmonella-Arten, die H produzierenzweiS; Hierzu hat es die Schwefelquelle, die durch Natriumthiosulfat dargestellt wird, und einen Reaktionsentwickler, der Eisenammoniumcitrat ist..
Letzterer reagiert mit dem H.zweiS (farbloses Gas) und bildet einen unlöslichen sichtbaren schwarzen Niederschlag von Eisensulfat. In diesem Sinne sind die Merkmale der Salmonellenkolonien rot mit einem schwarzen Zentrum..
Es ist zu beachten, dass für die Bildungsreaktion von H.zweiJa, ein alkalischer pH-Wert wird benötigt. Deshalb andere Enterobacteriaceae, die H bildenzweiS sie können es in diesem Medium nicht oder schlecht machen, weil die hohe Säure, die sie beim Fermentieren der vorhandenen Kohlenhydrate produzieren, die Reaktion hemmt oder behindert.
-Natriumchlorid, Agar und Phenolrot
Schließlich hält Natriumchlorid das osmotische Gleichgewicht aufrecht; Agar ist der Verfestiger und Phenolrot erkennt Änderungen des pH-Werts und verändert die Farbe der Kolonien und des Mediums.
Vorbereitung
55 g dehydriertes XLD-Medium abwiegen und in 1 Liter Wasser auflösen. Erhitze und rühre die Mischung, bis sie den Siedepunkt erreicht. Überhitzen Sie nicht, da Hitze das Medium schädigt und einen Niederschlag erzeugt, der die Morphologie typischer Kolonien verändert.
Dieses Medium darf nicht autoklaviert werden. Beim Auflösen muss es in ein Wasserbad bei 50 ° C gegeben werden. Beim Abkühlen sollte es direkt auf sterilen Petrischalen serviert werden. Sie können in Einzel- oder Doppelplatten gegossen werden. Sie werden erstarren gelassen und bis zur Verwendung im Kühlschrank aufbewahrt..
Vor Gebrauch temperieren. Da es sich um ein nicht steriles Medium handelt, wird empfohlen, es kurz vor dem Verwendungsdatum vorzubereiten..
Der endgültige pH-Wert des Mediums sollte 7,4 ± 0,2 betragen. Die Farbe des hergestellten Mediums ist orangerot, durchscheinend, ohne Niederschlag..
Wenn Sie Agar auf Xylose Lysin (XL) -Basis haben, können Sie Natriumdesoxycholat, Natriumthiosulfat und Eisenammoniumcitrat hinzufügen. Auf diese Weise wird die XLD-Agarformel erhalten.
Anwendungen
XLD-Agar wird zur Gewinnung von Enteropathogenen verwendet, hauptsächlich der Gattung Shigella und sekundär der Gattung Salmonella. Es ist nützlich für die Bewertung von Stuhl-, Wasser- und Lebensmittelproben.
Arten von Proben
Kot
Stuhlproben können direkt auf XLD-Agar ausgesät werden, wodurch eine gute Verteilung des Materials erzielt wird, um isolierte Kolonien zu erhalten.
Um die Salmonellenrückgewinnung zu verbessern, kann XLD-Agar aus Salmonellen-Anreicherungsmedien ausgesät werden..
Essen
Bei Lebensmitteln können Anreicherungsbrühen für Salmonellen und Shigellen verwendet werden. Für Salmonellen können Sie unter anderem Selenit-Cystin-Brühe, hellgrüne Tetrathionat-Brühe, verwenden..
Im Fall von Shigella kann es mit Shigella-Brühe mit 0,5 µ / ml Novobiocin angereichert und 16 bis 20 Stunden bei 42 ° ± 1 ° C inkubiert werden.
Wasser
Bei der Wasseranalyse werden unter anderem die Membranfiltrationstechnik und die Verwendung von XLD-Agar empfohlen..
Aussaat- und Identifikationsbedingungen
Das Impfmedium wird 24 bis 48 Stunden bei 35 ° C aerob inkubiert..
Die typischen Kolonien jeder Gattung werden beobachtet, die verdächtigen Kolonien sollten biochemischen Tests unterzogen werden, um sie zu identifizieren.
QA
Die folgenden Bakterienstämme können verwendet werden, um die Qualitätskontrolle des Mediums zu bewerten: Salmonella typhimurium ATCC 14028, Salmonella enteritidis ATCC 13076, Salmonellen-Abonie DSM 4224, Shigella flexneri ATCC 12022, Shigella sonnei ATCC 25931, Escherichia coli ATCC 25922, Proteus mirabilis ATCC 43071, Klebsiella pneumoniae ATCC 33495.
Die Gattung Salmonella zeichnet sich dadurch aus, dass sich in diesem Medium rote Kolonien mit einem schwarzen Zentrum oder vollständig schwarzen Kolonien präsentieren. Während in der Gattung Shigella die Kolonien rot sein müssen, dh die Farbe des Mediums.
Im Falle von Escherichia coli es wird erwartet, dass es ganz oder teilweise gehemmt wird; Wenn es wächst, sind die Kolonien gelb. Damit Proteus mirabilis Bei rosa Kolonien mit oder ohne schwarzem Zentrum wird ein schlechtes Wachstum erwartet. Schließlich wird die Gattung Klebsiella als gelbe Kolonien wachsen.
Abschließende Gedanken
XLD-Agar wird aufgrund seiner hohen Effizienz bei der Gewinnung von Shigella häufig in bakteriologischen Labors verwendet und weist auch eine gute Gewinnung der Gattung Salmonella auf.
Rall et al. (2005) zeigten in ihrer Arbeit mit dem Titel "Bewertung von drei Anreicherungsbrühen und fünf festen Medien zum Nachweis von Salmonellen bei Geflügel", dass von den drei getesteten klassischen Medien (hellgrüner Agar, SS-Agar und XLD-Agar) XLD Agar hatte die beste Wiederfindungsrate.
Die Wiederfindungsprozentsätze waren wie folgt: 13,8% für hellgrünen Agar, 27,6% für SS und 34,5% für XLD. Es wurde nur von dem chromogenen Medium Rambach-Agar mit 48% Wiederfindung und dem CHROMagar mit 79,3% übertroffen.
Verweise
- Lebensmittelbedingte Krankheiten. Shigellose. Verfügbar unter: anmat.gov.ar
- "XLD-Agar." Wikipedia, die freie Enzyklopädie. 9. Februar 2019, 11:46 UTC. 10. April 2019, 19:25 Uhr wikipedia.org
- BBL Laboratories. CHROMagar Salmonella / BD XLD Agar (Biplate). 2013 Verfügbar unter: bd.com
- Lab. Neogen. XLD-Agar. Verfügbar unter: Foodsafety.neogen
- Francisco Soria Melguizo Labor. XLD-Agar. Verfügbar unter: http://f-soria.es/Inform
- Rall L, Rall R, Aragon C, Silva M. Bewertung von drei Anreicherungsbrühen und fünf Plattierungsmedien zum Nachweis von Salmonellen bei Geflügel. Braz. J. Microbiol. 2005; 36 (2): 147 & ndash; 150. Erhältlich bei: scielo.br
- Forbes B., Sahm D., Weissfeld A. (2009). Bailey & Scott Mikrobiologische Diagnose. 12 ed. Editorial Panamericana S.A. Argentinien.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.