
Basis, Zubereitung und Verwendung von Kartoffel-Dextrose-Agar
Das Kartoffel-Dextrose-Agar Es ist ein festes, nicht selektives Nährkulturmedium. Bakterien- und Pilzarten können darin wachsen, aber seine Verwendung ist besonders für die Isolierung von Fadenpilzen und Hefen angezeigt. Es ist auch als PDA-Medium für den englischen Ausdruck Potato Dextrose Agar bekannt.
Es ist besonders nützlich für die Isolierung von phytopathogenen Pilzen, dh solchen, die Pflanzen betreffen. Um die Proben von infiziertem Gemüse zu säen, können andere Mittel wie Sabouraud-Agar oder Malta-Agar verwendet werden. Für die routinemäßige Verwendung wird jedoch Kartoffel-Dextrose-Agar bevorzugt, da eine stärkere Sporulation erzielt wird..
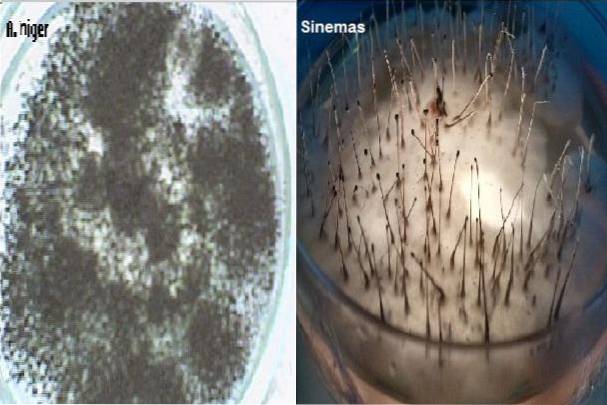
Es wird auch zur Zählung von Pilzkolonien in Proben von Kosmetika, pharmazeutischen Produkten und einigen Milchprodukten verwendet. Ebenso eignet es sich zur Aussaat von Hautkratzproben auf der Suche nach Dermatophyten, die in diesem Medium sehr gut wachsen und ihre charakteristischen Pigmente entwickeln..
Kartoffel-Dextrose-Medium ist ein sehr einfaches und leicht im Labor herzustellendes Medium. Enthält, wie der Name schon sagt, eine Infusion von Kartoffeln, Dextrose und Agar-Agar. Zusätzlich können hemmende Substanzen hinzugefügt werden, um das Bakterienwachstum zu verhindern und die Selektivität für Pilzarten zu erhöhen..
Artikelverzeichnis
- 1 Begründung
- 2 Vorbereitung
- 2.1 - Hausgemachte (nicht kommerzielle) Herstellung von Kartoffel-Dextrose-Agar
- 2.2 - Kommerzielle Herstellung von Kartoffel-Dextrose-Agar
- 3 Verwendungen
- 3.1 Verfahren zur Aussaat von Pflanzenproben auf Kartoffel-Dextrose-Agar
- 3.2 Verfahren zum Aussäen von Haut-, Haar- oder Nagelschuppenproben auf Kartoffel-Dextrose-Agar
- 3.3 Identifikationsverfahren
- 3.4 Anzahl der Kolonien
- 3.5 Erhaltung von Pilzstämmen
- 4 Qualitätskontrolle
- 5 Referenzen
Basis
Kartoffel-Dextrose-Agar ist ein Kulturmedium, das die für die Entwicklung von Fadenpilzen und Hefen erforderlichen Nährstoffe liefert..
Die Kombination der Infusion von Kartoffeln mit Glukose bietet die perfekte Energiequelle für ein zufriedenstellendes Wachstum von Pilzen. Während der Agar derjenige ist, der dem Medium die Konsistenz verleiht.
Das Medium selbst hemmt das Wachstum von Bakterien nicht, daher ist es ein nicht selektives Medium. Um es selektiv zu machen, müssen hemmende Substanzen wie Weinsäure oder Antibiotika hinzugefügt werden..
Vorbereitung
-Hausgemachte (nicht kommerzielle) Zubereitung von Kartoffel-Dextrose-Agar
Petrischalen
Es wird wie folgt hergestellt:
Erstens werden die Kartoffeln sehr gut gewaschen, wobei der Boden, den sie besitzen, entfernt wird. Sie werden mit allem und der Schale in dünne Scheiben geschnitten. 200 g Kartoffeln werden gewogen und eine halbe Stunde in einem Liter destilliertem Wasser gekocht.
Filtern oder passieren Sie am Ende der Zeit die gesamte Zubereitung durch ein Käsetuch.
Die erhaltene Flüssigkeit wird mit destilliertem Wasser bis zu einem Liter vervollständigt. 20 g Agar-Agar und 20 g Dextrose zur Infusion geben, gut mischen und 15 Minuten bei 121 ° C und 15 Pfund Druck autoklavieren..
Auf 50 ° C abkühlen lassen und in sterilen Petrischalen servieren. Die vorbereiteten Teller werden im Kühlschrank aufbewahrt..
Keile
Kartoffel-Dextrose-Agar-Keile können ebenfalls hergestellt werden..
In diesem Fall werden vor dem Sterilisieren im Autoklaven 12 bis 15 ml des Mediums in Röhrchen gegeben, später werden sie autoklaviert und liegen beim Verlassen auf speziellen Trägern, bis es sich verfestigt. Im Kühlschrank aufbewahren.
Das Medium bleibt bei einem pH-Wert von 5,6 ± 0,2. Einige Laboratorien fügen jedoch 10% Weinsäure hinzu, um den pH-Wert auf 3,1 ± 0,1 zu senken und das Bakterienwachstum zu hemmen..
In diesem Sinne bevorzugen andere Laboratorien die Zugabe von Antibiotika, um sie für die Kultivierung von Pilzen selektiv zu machen und die Entwicklung von Bakterien zu verhindern..
-Kommerzielle Herstellung von Kartoffel-Dextrose-Agar
39 g des im Handel erhältlichen dehydrierten Mediums werden abgewogen und in einem Liter destilliertem Wasser gelöst. 5 Minuten stehen lassen.
Die Mischung wird unter häufigem Rühren erhitzt, bis sie vollständig aufgelöst ist. Anschließend wird es in einem Autoklaven 15 Minuten bei 121 ° C sterilisiert..
Platten oder Keile können vorbereitet werden. Gehen Sie wie oben beschrieben vor.
Der pH-Wert beträgt 5,6 ± 0,2. Wenn der pH-Wert von 3,1 gewünscht wird, sollten vor dem Servieren auf den Platten 14 ml sterile 20% ige Weinsäure zugegeben werden..
Das Rohmedium ist beige und das vorbereitete Medium ist hell bernsteinfarben mit einem leicht trüben oder opaleszierenden Aussehen..
Anwendungen
Verfahren zur Aussaat von Pflanzenproben auf Kartoffel-Dextrose-Agar
-Für gefleckte Blätter
Die Blätter werden in Stücke geschnitten.
Legen Sie die Blattstücke (fleckige und gesunde Stücke) in ein 50-cm³-Glas mit 50% Alkohol, um die Oberfläche 20 bis 30 Sekunden lang zu desinfizieren. Werfen Sie den Alkohol weg und fügen Sie 20% Natriumhypochlorit für 40 bis 50 Sekunden hinzu, wenn es sich um dünne Blätter handelt, und erhöhen Sie die Zeit auf 80 Sekunden, wenn es sich um Rinde und Holzstämme handelt.
Entsorgen Sie das Natriumhypochlorit, nehmen Sie die desinfizierten Teile mit einer sterilen Pinzette und legen Sie sie auf die Oberfläche des Mediums (maximal 10 Teile). Datum und Inkubation bei 20-30 ° C..
-Für Früchte und Knollen
Wenn die Frucht fleischig ist, öffnen Sie die vom Pilz befallene Frucht und nehmen Sie Stücke mit einem sterilen Skalpell, sowohl von den erkrankten als auch von den gesunden Teilen, und legen Sie sie auf die Oberfläche des Agars.
Wenn es sich bei der Frucht um Zitrusfrüchte wie eine Zitrone oder eine Orange handelt, muss sie geöffnet und die Samen ausgesät werden.
Wenn die Oberfläche der Frucht betroffen ist und Sporen beobachtet werden, ist es ideal, die Gittermethode auf dem Teller anzuwenden. Dies besteht darin, die Sporen mit einem sterilisierten und gekühlten L-förmigen Spatel zu berühren und dann zwei- bis dreimal im Zickzack auf den Agar zu säen.
-Für Getreide
Sie werden wie in den Blättern beschrieben desinfiziert und später auf den Agar gelegt.
-Für Zweige und Stängel
Die Rinde wird abgekratzt und später werden Teile des gesunden und erkrankten Teils entnommen und direkt auf den Agar gesät.
Die ausgesäten Platten werden 72 Stunden bei 20-30ºC aerob inkubiert.
Verfahren zum Aussäen von Haut-, Haar- oder Nagelschuppenproben auf Kartoffel-Dextrose-Agar
Die Probenahme sollte mit einer Skalpellklinge Nr. 11 erfolgen, um betroffene Haare, Hautschuppen oder Nägel auf der Suche nach Dermatophyten zu schneiden. Vor der Probenahme muss der Bereich mit 70% igem Alkohol desinfiziert werden..
-Hautprobe
Bei schuppigen Läsionen sollte der Rand der Läsion abgekratzt werden, da der Pilz dort eher gefunden wird.
Bei exsudativen Läsionen wird die Probe mit einem trockenen oder feuchten Tupfer entnommen. Sofort auf Kartoffel-Dextrose-Agar oder Sabouraud-Agar säen. Transportmittel vermeiden.
Eine andere Methode zur Probenahme ist die Teppichquadrattechnik von Mariat und Adan Campos. In diesem Fall wird die betroffene Stelle fünfmal mit einem Stück steriler Wolle zur späteren Kultivierung eingerieben..
Die Probe kann direkt in das Kulturmedium gegeben werden.
-Haarprobe
Je nach Pathologie kann der betroffene Teil abgeschnitten oder entwurzelt werden. Legen Sie die Probe in das Kulturmedium.
-Nagelprobe
Ein bestimmter Teil des betroffenen Nagels kann abgekratzt oder geschnitten werden. Dies hängt von der Art der Verletzung ab.
Schneiden Sie die Probe vor der Aussaat in 1 mm große Stücke, um die Wahrscheinlichkeit eines Kontakts des Pilzes mit dem Kulturmedium zu erhöhen..
Identifikationsverfahren
Die in der Platte erhaltenen Kolonien werden in Röhrchen isoliert, die Kartoffel-Dextrose-Agar enthalten, um die makroskopische Untersuchung der Kolonien (Aussehen, Farbe, Konsistenz, Entwicklungsgrad) durchzuführen.
Die mikroskopische Untersuchung (Beobachtung von Strukturen und ihren Formationen) kann durch Mikrokulturen oder direkte Beobachtung unter dem Mikroskop zwischen Lamina und Lamelle erfolgen..
Kolonienzahl
Dieses Medium kann auch verwendet werden, um die Pilz- und Hefebelastung in Pflanzen-, Lebensmittel-, Kosmetik- oder Arzneimittelproben zu bestimmen. Zu diesem Zweck wird mit Antibiotika ergänzter Kartoffel-Dextrose-Agar verwendet, wie z. B.: (Chloramphenicol, Chlortetracyclin oder beides).
Gießen Sie 1 ml der Probe - vorzugsweise verdünnt - in eine sterile und leere Petrischale, schmelzen Sie dann einen Stopfen Kartoffel-Dextrose-Agar und lassen Sie ihn auf 45 ° C abkühlen. Auf die Petrischale gießen und bis zur Homogenisierung drehen. Stehen lassen, bis es fest ist.
Je nach Art des gesuchten Pilzes und Art der Probe 5 bis 7 Tage oder länger aerob bei 20-25 ° C (Schimmelpilze) oder 30-32 ° C (Hefen) inkubieren. In beiden Temperaturbereichen können zwei Platten zur Inkubation verwendet werden.

Erhaltung von Pilzstämmen
Kartoffel-Dextrose-Agar kann verwendet werden, um lebensfähige Pilzstämme über mehrere Jahre zu erhalten.
Zu diesem Zweck wird der Pilz in Keilen aus Kartoffel-Dextrose-Agar gezüchtet und nach dem Wachstum des Pilzes mit Mineralöl bedeckt. Das Öl sollte 45 Minuten in einem Autoklaven sterilisiert werden und eine Viskosität von ungefähr 300 bis 330 Saybolt haben. Das Öl sollte 1 bis 2 cm über der Spitze der Abschrägung liegen.
QA
Von jeder hergestellten Charge sollten 1 oder 2 Platten entnommen und 48 Stunden bei 25 ° C oder 96 Stunden bei 20 ° C inkubiert werden. Eine gute Sterilitätskontrolle ist eine, bei der keine Kolonieentwicklung beobachtet wird..
Bekannte oder zertifizierte Kontrollstämme wie:
Saccharomyces cerevisiae ATCC 9763, Candida albicans ATCC 10231, Aspergillus brasiliensis ATCC 16404, Trichophyton-Mentagrophyten ATCC 9533. In allen Fällen wird ein gutes Wachstum erwartet.
Verweise
- Britannia Laboratories. Glukose-Agar-Kartoffel. 2015. Verfügbar unter: britanialab.com
- Neogen Laboratories. Kartoffel-Dextrose-Agar. Verfügbar unter: Foodsafety.neogen.com
- Insumolab Labor. Kartoffel-Dextrose-Agar. Verfügbar unter: insumolab.cl
- Forbes B., Sahm D., Weissfeld A. (2009). Bailey & Scott Mikrobiologische Diagnose. 12 ed. Editorial Panamericana S.A. Argentinien.
- Casas-Rincón G. Allgemeine Mykologie. 1994. 2. Aufl. Central University of Venezuela, Library Editions. Venezuela Caracas.
- Aceituno M. Bewertung der mikrobiologischen Qualität in Lidschatten, Kompaktpulvertyp eines nationalen Produktionslabors, gemäß der Referenzmethode Pharmacopea Usp 2005. Abschlussarbeit zur Qualifikation zum Pharmazeutischen Chemiker. Universität von San Carlos von Guatemala.
- Cuétara M. Verarbeitung von Oberflächenproben. Iberoamerikanisches Journal für Mykologie. 2007; pp. 1-12


history essay help <a href=https://bestessaysden.com>community service essays</a> write my essay fast
academic essay services <a href=https://bestessayreviews.net>best websites for essays</a> essay on help
buy an essay cheap <a href=https://besteasyessays.org>cheap essay writing service usa</a> essay on help
essay help college <a href=https://bestcampusessays.com>i need help writing a narrative essay</a> essays to buy
best essay writer company <a href=https://au-bestessays.org>essay help 123</a> urgent custom essays