
Müeller Hinton Agar Grundierung, Vorbereitung und Verwendung
Das Müeller Hinton Agar Es ist ein festes, nicht selektives Nährmedium, das aus Fleischinfusion, saurem Kaseinpepton, Stärke, Agar und destilliertem Wasser besteht. Dieses Medium ermöglicht ein ausgezeichnetes mikrobielles Wachstum der meisten schnell wachsenden Bakterien.
Es wurde ursprünglich von John Howard Müeller und Jane Hinton entwickelt, um ernährungsphysiologisch anspruchsvolle Bakterien wie z Neisseria gonorrhoeae Y. Meningokokken. Aufgrund seiner Eigenschaften erwies es sich jedoch als ideal für die Untersuchung der Empfindlichkeit gegenüber Antibiotika und lieferte zuverlässige und reproduzierbare Ergebnisse..
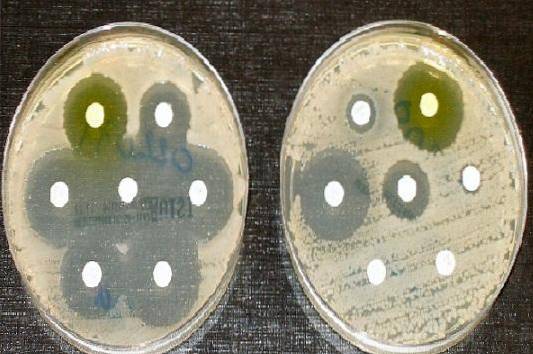
Daher ist Müeller-Hinton-Agar das vom Clinical and Laboratory Standards Institute (CLSI) und dem Europäischen Komitee für antimikrobielle Empfindlichkeitstests für die Durchführung des antimikrobiellen Empfindlichkeitstests nach der Kirby-Scheibendiffusionsmethode und Bauer akzeptierte Kulturmedium.
Artikelverzeichnis
- 1 Begründung
- 2 Vorbereitung
- 3 Verwendungen
- 3.1 Die Antibiogrammtechnik
- 3.2 Strategische Platzierung von Scheiben auf Müeller Hinton Agar
- 4 Ursachen für fehlerhafte Ergebnisse
- 5 Einschränkung
- 6 Qualitätskontrolle
- 7 Referenzen
Basis
Als nicht selektives Nährmedium eignet es sich hervorragend für das Wachstum der meisten pathogenen Bakterien..
Andererseits lässt seine einfache Zusammensetzung die Substanzen leicht darauf diffundieren, was ein wesentliches Merkmal für den Empfindlichkeitstest durch das Scheibendiffusionsverfahren ist..
Eine weitere Eigenschaft ist, dass es eine geringe Menge an Inhibitoren enthält, wodurch Sulfonamide, Trimethoprim und Tetracycline effektiv bewertet werden können..
Es muss jedoch berücksichtigt werden, dass das Medium bestimmte Bedingungen erfüllen muss, um sein ordnungsgemäßes Funktionieren sicherzustellen, einschließlich:
Die Einstellung des pH-Wertes, der Tiefe des Agars und der geeigneten Konzentration von Thymin, Thymidin, Ca.++, Mg++ und Zn++.
Sie müssen auch wissen, dass die Methodik standardisiert ist und daher alle Parameter erfüllt sein müssen, wie z.
Die Inokulumkonzentration, die Konzentration und Konservierung der Antibiotika-Scheiben, die Platzierung der entsprechenden Anzahl von Scheiben auf dem Agar, der Abstand zwischen einer Scheibe und einer anderen, die strategische Platzierung bestimmter Antibiotika, die Atmosphäre, die Temperatur und die Inkubationszeit.
Vorbereitung
37 g dehydriertes Müeller-Hinton-Medium werden abgewogen und in 1 Liter destilliertem Wasser gelöst. Erhitze das Medium unter Rühren, um die Auflösung zu unterstützen. 1 Minute kochen lassen.
Autoklavieren, um 15 Minuten bei 121 ° C zu sterilisieren. Beim Herausnehmen aus dem Autoklaven sollte der Kolben zum Abkühlen in ein Wasserbad bei 50 ° C gestellt werden. Gießen Sie 25 bis 30 ml in sterile Petrischalen mit 10 cm Durchmesser.
Die Platten sollten eine durchschnittliche Dicke von 4 mm (ideal) haben und einen Bereich von 3-5 mm haben.
Wenn Blutagar mit Müeller-Hinton-Agar als Basis hergestellt werden soll, gießen Sie vor dem Servieren auf die Platten 5% steriles und defibriniertes Lammblut..
Der endgültige pH-Wert des Mediums sollte zwischen 7,2 und 7,4 liegen.
Investieren und bis zur Verwendung im Kühlschrank aufbewahren. Lassen Sie die Platte vor Gebrauch auf Raumtemperatur kommen.
Die Farbe des vorbereiteten Mediums ist hellbeige.
Anwendungen
Wird verwendet, um das Antibiogramm oder den Antibiotika-Empfindlichkeitstest für die meisten schnell wachsenden nicht anspruchsvollen Krankheitserreger durchzuführen.
Wenn der Agar mit Blut ergänzt wird, wird er verwendet, um das Antibiogramm anspruchsvoller Mikroorganismen durchzuführen, wie z. Streptococcus pneumoniae, Haemophilus sp., Neisseria meningitidis, unter anderen. Es wurde auch verwendet, um zu isolieren Legionella pneumophila.
Antibiogramm-Technik
Vor der Durchführung des Antibiogramms muss eine Bakterienlösung hergestellt werden, die 1,5 x 10 entspricht.8 Zellen.
Hierzu werden 3 bis 4 Kolonien der Reinkultur entnommen und in einer Sojabohnen-Trypticase-Brühe oder in Müeller-Hinton-Brühe suspendiert, 2 bis 6 Stunden inkubiert und die Konzentration mit steriler Kochsalzlösung eingestellt, wobei sie mit einem Mac Farland-Standard von 0,5 verglichen wird %..
Wenn sie Mikroorganismen benötigen, können Kolonien direkt bis zu einer Konzentration von 0,5% Mac Farland suspendiert werden. Anschließend wird die Müeller Hinton-Platte mit einem mit der vorbereiteten Bakterienlösung imprägnierten Tupfer ausgesät..
Dazu wird der Tupfer in die Lösung eingetaucht und anschließend die überschüssige Flüssigkeit durch Drücken gegen die Wände des Röhrchens entfernt. Unmittelbar danach wird der Tupfer über die gesamte Oberfläche geführt, wobei keine Stellen unberührt bleiben. Dann wird die Platte leicht gedreht und erneut ausgesät. Der Vorgang wird noch zweimal wiederholt.
10 Minuten stehen lassen und dann die Antibiotika-Scheiben mit einer sterilen Pinzette befestigen, wobei ein Abstand von 24 mm zwischen ihnen verbleibt. Nachdem Sie jede Scheibe auf den Agar gelegt haben, drücken Sie leicht mit der Pinzette auf jede Scheibe, um sicherzustellen, dass sie gut haftet..
Nach Beendigung des Prozesses wird die Platte umgedreht und 16 bis 18 Stunden bei 35 bis 37 ° C in Aerobiose inkubiert. Wenn es sich um einen anspruchsvollen Mikroorganismus handelt, kann dies eine Mikroaerophilie rechtfertigen. Wenn das Antibiogramm Oxacillin-Scheiben enthält, sollte es nach 24 Stunden abgelesen werden..
Ein Lineal wird verwendet, um den Durchmesser jedes Halos zu messen. Die Ergebnisse sollten in mm aufgezeichnet werden. Anschließend werden die erhaltenen Werte mit den im aktuellen CLSI-Handbuch veröffentlichten Schnittpunkttabellen korreliert..

Melden Sie sich je nach Fall als empfindlich (S), mittelschwer (I) oder resistent (R).
Antibiotika werden nach dem isolierten Mikroorganismus und der Art der Infektion ausgewählt, die sie verursacht.
Manchmal muss die strategische Platzierung von Antibiotika berücksichtigt werden, um phänotypische Resistenzmuster aufzuzeigen.
Strategische Platzierung von Scheiben auf Müeller Hinton Agar
Bei Enterobakterien sollte die Clavulansäurescheibe gegen Cephalosporine der 3. und 4. Generation platziert werden. Eine eiförmige Verbreiterung zeigt an, dass der Stamm ein Produzent von Beta-Lactamasen mit erweitertem Spektrum (ESBL) ist. Dies bedeutet, dass der Patient nicht mit Cephalosporinen behandelt werden sollte..
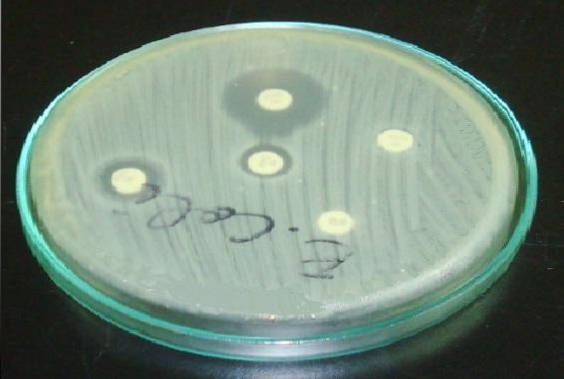
Bei Staphylococcus ist es wichtig, die Erythromycin- oder Azithromycin-Scheibe vor die Clindamycin-Scheibe zu legen (D-Test).
Ein resistenter Halo in Erythromycin und eine Abflachung im Clindamycin-Halo zeigen an, dass der Stamm eine durch Stamm induzierbare Clindamycin-Resistenz (ICR) besitzt. Dies bedeutet, dass eine Behandlung mit Clindamycin nicht wirksam ist..
Bei der Suche nach induzierbaren AMP C-Stämmen in Enterobacteriaceae und einigen nicht fermentierenden gramnegativen Stäbchen werden Ceftazidim-, Cefoxitin- oder Piperacillin-Tazobactan-Scheiben in einem Abstand von 27 mm gegen eine Imipenem-Scheibe gerichtet.
Ein abgeflachter Lichthof in einer der Scheiben, die dem Imipenem zugewandt sind, zeigt das Vorhandensein von induzierbarem AMP C an.
Für die Suche nach konstitutivem C-AMP wird eine 500-µg-Cloxacillin-Scheibe in einem Abstand von 25 mm mit Ceftazidim (30 µg) und Cefotaxim (30 µg) konfrontiert. Ein verbreiterter Lichthof in einem der Cephalosporine zeigt Positivität an.
Die Cloxacillinscheibe kann auch durch eine 9 mm Scheibe Whatman Nr. 6-Filterpapier ersetzt werden, die mit Phenylborsäure (400 ug) in einem Abstand von 18 mm imprägniert ist. Es wird genauso interpretiert wie das vorherige.
Schließlich soll die Produktion von Metallobetalactamasen insbesondere in untersucht werden Pseudomonas aeruginosa, Es wird eine mit 10 ul Ethylendiamintetraessigsäure (EDTA 750 ug) und Thioglykolsäure (SMA 300 ug) imprägnierte Scheibe verwendet, die in einem Abstand von 15 mm den Imipenem- und Meropenemscheiben zugewandt ist.
Der Test ist positiv, wenn sich die Imipenem- oder Meropenem-Halos zur EDTA / SMA-Platte hin verbreitern. Dieses Ergebnis muss durch den modifizierten Hodge-Test bestätigt werden..
Diese Methode besteht aus dem Inokulieren eines Stammes von Escherichia coli ATCC 25922 auf der Müeller Hinton Platte. Eine Imipenemscheibe wird in die Mitte der Platte gelegt, und dann wird ein Streifen von der Scheibe in Richtung der Peripherie mit der Dehnung von gemacht P. aeruginosa verdächtig. Pro Platte können bis zu 4 Stämme getestet werden.
Der Test ist positiv, wenn sich um die Dehnungsstreifen eine Verzerrungszone des Imipenem-Halos befindet.
Ursachen für fehlerhafte Ergebnisse
-Schlecht konservierte Antibiotika-Scheiben können zu falscher Resistenz führen. Beispielsweise ist die Oxacillinscheibe sehr anfällig für Temperaturänderungen..
-Ein pH-Wert des Mediums unter dem angegebenen Wert (sauer) erzeugt kleinere Halos in Aminoglycosiden und Makroliden (Risiko einer falschen Resistenz) und größere Halos in Penicillin, Tetracyclin und Novobiocin (Risiko einer falschen Empfindlichkeit)..
-Wenn der pH-Wert über dem angegebenen Wert (alkalisch) liegt, sind die oben beschriebenen Effekte umgekehrt.
-Medien mit erhöhten Thymin- und Thymidinkonzentrationen haben einen Einfluss, indem sie die Hemmhalos von Sulfonamiden und Trimethoprim signifikant reduzieren..
-Hohe Konzentrationen von Calcium und Magnesium führen zu einer falschen Resistenz von Aminoglycosiden, Polymyxin B und Tetracyclinen gegen Stämme von Pseudomonas aeruginosa.
-Niedrige Konzentrationen von Calcium und Magnesium führen zu einer falschen Empfindlichkeit von Aminoglycosiden, Polymyxin B und Tetracyclinen gegenüber Stämmen von Pseudomonas aeruginosa.
-Das Vorhandensein von Zink beeinflusst die Ergebnisse von Carbapenem-Scheiben (Imipenem, Meropenem und Ertapenem)..
-Eine Mediendicke unter 3 mm führt zu falschen Empfindlichkeitsergebnissen, während eine Dicke über 5 zu einer falschen Beständigkeit führt.
-Die Mobilisierung von Bandscheiben im Antibiogramm führt zu deformierten Lichthöfen, da die Abgabe von Antibiotika sofort erfolgt.
- Sehr schwache Inokula beeinflussen die Ergebnisse, da es kein gleichmäßiges oder konfluentes Wachstum des Agars gibt, eine notwendige Bedingung, um die Hemmhalos messen zu können, zusätzlich zu der Tatsache, dass die Halos größer als normal sein können.
-Überlastete Inokulate können kleinere als normale Lichthöfe ergeben.
-Wenn der Abstand zwischen den Discs nicht beachtet wird, überlappt sich ein Lichthof mit einem anderen und sie können nicht richtig gelesen werden.
-Mit CO inkubierenzwei erhöht die Größe der Lichthöfe der Tetracyclin- und Methicillinscheiben.
-Bei Inkubation bei Temperaturen unter 35 ° C entstehen größere Lichthöfe.
-Die Zugabe von Blut verringert die Größe des Sulfonamidhalos.
Einschränkung
Die im Antibiogramm nachgewiesene Empfindlichkeit eines Antibiotikums gegen einen Mikroorganismus (in vitro) ist keine Garantie dafür, dass es funktioniert in vivo.
QA
Um zu wissen, ob das Medium die ausreichende Menge an Thymin enthält, muss ein Stamm gezüchtet werden Enterococcus faecalis ATCC 29212 und testen Sie die Empfindlichkeit gegenüber Trimethoprimsulfamethoxazol (SXT). Um zufriedenstellend zu sein, muss ein Lichthof von mindestens> 20 mm erhalten werden.
Verweise
- "Müller-Hinton-Agar." Wikipedia, die freie Enzyklopädie. 16. November 2018, 12:23 UTC. 27. Januar 2019, 04:22
- Forbes B., Sahm D., Weissfeld A. (2009). Bailey & Scott Mikrobiologische Diagnose. 12 ed. Editorial Panamericana S.A. Argentinien.
- Cona E. Bedingungen für eine gute Suszeptibilitätsstudie durch Agardiffusionstest. Rev Chil Infect, 2002; 19 (2): 77 & ndash; 81
- Difco Francisco Soria Melguizo Labor. Müeller Hinton Agar mit 5% Schafblut. 2009. Verfügbar unter: http://f-soria.es
- BD Müeller Hinton II Agar Labor. 2017. Verfügbar unter: .bd.com
- Britannia Laboratories. Müeller Hinton Agar. 2015. Verfügbar unter: britanialab.com
- Koneman E., Allen S., Janda W., Schreckenberger P., Winn W. (2004). Mikrobiologische Diagnose. 5. Aufl. Editorial Panamericana S.A. Argentinien.
- Martínez-Rojas D. Betalactamasen vom AmpC-Typ: Allgemeines und Methoden zum phänotypischen Nachweis. Rev. Soc. Ven. Microbiol. 2009; 29 (2): 78 & ndash; 83. Verfügbar unter: scielo.org.
- Perozo A, Castellano M, Ling E, Arraiz N. Phänotypischer Nachweis von Metallobetalactamasen in klinischen Isolaten von Pseudomonas aeruginosa. Kasmera, 2012; 40 (2): 113-121. Verfügbar unter: scielo.org.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.