
Agar Account Standard Begründung, Vorbereitung und Verwendung
Das Agar-Standardanzahl Es ist ein festes, nicht selektives Kulturmedium, das unter anderem zur Quantifizierung der aeroben mikrobiellen Belastung in Proben von Trinkwasser, Abwasser und Milchgetränken bestimmt ist. Dieses Medium ist auch als PCA-Agar bekannt, für sein Akronym in English Plate Count Agar. Es wurde 1953 von Buchbinder, Baris und Goldstein gegründet.
Das Standardzählagarmedium besteht aus Hefeextrakt, Triptein, Glucose, Agar und destilliertem Wasser. Diese Formulierung enthält grundlegende Ernährungselemente, die die Entwicklung der gegenwärtigen aeroben mikrobiellen Belastung ermöglichen, ohne es zu fordern.
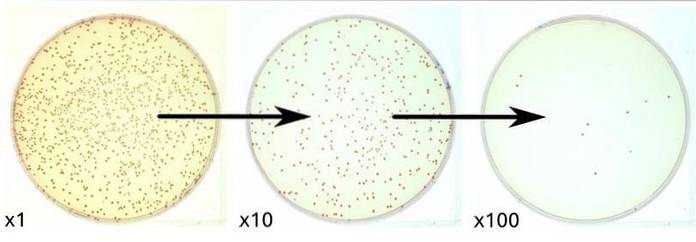
Da das Medium keine Inhibitoren enthält, können Bakterien ohne Einschränkungen wachsen, was es ideal für die allgemeine Kolonienzählung macht. Die Plattenquantifizierungstechnik erkennt jedoch nicht alle vorhandenen Bakterien, sondern nur diejenigen, die unter den Umgebungsbedingungen wachsen können, denen der ausgesäte Standardzählagar ausgesetzt ist..
In diesem Sinne versucht die Plattenquantifizierungstechnik im Allgemeinen, die Menge an Bakterien vom aeroben mesophilen Typ zu bestimmen, dh diejenigen, die sich bei Temperaturen zwischen 25 und 40 ° C mit einer optimalen Wachstumstemperatur von 37 ° C entwickeln..
Diese Bakteriengruppe ist sehr wichtig, da dort die meisten pathogenen Bakterien für den Menschen gefunden werden..
Es sollte beachtet werden, dass es manchmal von Interesse sein kann, die Menge an in Lebensmitteln vorhandenen psychrophilen Bakterien zu quantifizieren. Diese Bakterien entwickeln sich bei niedrigen Temperaturen (< 20°C) y son las responsables de que los alimentos se descompongan más rápido, aun estando en nevera.
Ebenso können thermophile Bakterien, die sich in einem Bereich zwischen 50 ° C und 80 ° C oder mehr entwickeln, bei bestimmten Arten von Lebensmitteln wie Konserven wichtig sein..
Die mikrobielle Quantifizierung wird in koloniebildenden Einheiten (KBE) pro Gramm oder Milliliter Probe ausgedrückt.
Artikelverzeichnis
- 1 Begründung
- 2 Vorbereitung
- 2.1 Für die Gießplattentechnik
- 2.2 Zur Oberflächensaat
- 3 Verwenden Sie
- 3.1 Plattengusstechnik (Tiefensaat)
- 3.2 Oberflächensaattechnik
- 4 Qualitätskontrolle
- 5 Einschränkungen
- 6 Referenzen
Basis
Das Standardzählmedium wurde entwickelt, um das erfolgreiche Wachstum nicht anspruchsvoller aerober Bakterien zu ermöglichen, da der Hefeextrakt, Triptein und Glucose die notwendigen Nährstoffe für ein gutes mikrobielles Wachstum liefern..
Andererseits hat das Medium eine helle Farbe und ein transparentes Aussehen, weshalb es ideal für die Visualisierung von Kolonien ist, die durch die Deep-Seeding-Methode (Plattengießen) entwickelt wurden..
Eine Kolonienzählung nach der Drigalski-Spatel-Oberflächen-Seeding-Methode ist ebenfalls möglich..
Wenn die mikrobielle Belastung hoch ist, müssen Dezimalverdünnungen der untersuchten Probe vorgenommen werden, um die KBE zählen zu können.
Es ist zu beachten, dass dieses Medium von der American Public Health Association (APHA) für die Zählung von aeroben Mesophilen empfohlen wird..
Vorbereitung
23,5 g des dehydrierten Mediums werden gewogen und in einem Liter destilliertem Wasser gelöst. Um sich vollständig aufzulösen, sollte die Mischung durch häufiges Rühren erhitzt werden, bis sie kocht. Die nächsten Schritte hängen von der zu verwendenden Aussaattechnik ab.
Für die Gießplattentechnik
Verteilen Sie es, indem Sie 12 bis 15 ml in Reagenzgläser geben. Anschließend 15 Minuten in einem Autoklaven bei 121 ° C sterilisieren. Vertikal in Form eines Blocks erstarren lassen. Bis zur Verwendung im Kühlschrank aufbewahren.
Schmelzen Sie den Stecker, wenn Sie ihn verwenden möchten. Nach dem Schmelzen in einem Wasserbad bei 44-47 ° C aufbewahren, während die Proben vorbereitet werden..
Zur Oberflächensaat
Sterilisieren Sie das Medium in einem Autoklaven bei 121 ° C und verteilen Sie dann 20 ml in sterilen Petrischalen. Erstarren lassen, umdrehen und bis zur Verwendung im Kühlschrank aufbewahren.
Temperplatten vor Gebrauch. Der pH-Wert des Mediums muss 7,0 ± 0,2 betragen.
Benutzen
Standardzählagar wird in der aeroben Mesophilenzählungstechnik während der mikrobiologischen Analyse von Wasser und Lebensmitteln verwendet. Die Zählung der aeroben Mesophilen ist notwendig, da sie die hygienische Qualität der untersuchten Probe bestimmt..
Die Anwendung dieser Technik (unter Verwendung dieses Mediums) ermöglicht die makroskopische Visualisierung isolierter Kolonien zur Quantifizierung..
Plattengusstechnik (Tiefensaat)
-Prozess
Die Technik besteht aus Folgendem:
1) Homogenisieren Sie die Probe, um die vorhandenen Bakterien neu zu verteilen.
2) Eine anfängliche Suspension wird in einer sterilen Flasche oder einem sterilen Beutel unter Berücksichtigung des Verhältnisses von 10 g oder 10 ml Probe in 90 ml Verdünnungsmittel (10) hergestellt-1).
3) Ausgehend von der anfänglichen Suspension werden die entsprechenden Dezimalverdünnungen in Abhängigkeit von der Art der Probe vorgenommen. Beispiel: (10-zwei, 10-3, 10-4). Verdünnungen werden mit Peptonwasser oder Phosphatpuffer durchgeführt..
Nehmen Sie dazu 1 ml der ursprünglichen Suspension und geben Sie sie in 9 ml Verdünnungsmittel. Setzen Sie die Verdünnungen gegebenenfalls fort und nehmen Sie nun 1 ml der Verdünnung 10-zwei und so weiter.
4) Nehmen Sie 1 ml jeder Verdünnung und legen Sie sie in leere sterile Petrischalen.
5) Zu jeder Platte 12 bis 15 ml Standardzählagar geben, der zuvor geschmolzen und bei 44 - 47 ° C abgesetzt wurde.
6) Drehen Sie die Platten vorsichtig, um die Probe gleichmäßig auf dem Agar zu verteilen und erstarren zu lassen..
7) Drehen Sie die Platten um und inkubieren Sie 24 bis 48 Stunden bei 37 ° C in Aerobiose.
8) Am Ende der Zeit werden die Platten untersucht und die Kolonien in der Verdünnung gezählt, die dies zulässt. Die Platten mit 30 bis 300 KBE werden für die Zählung ausgewählt.
Das Zählen kann manuell erfolgen oder Sie können die Koloniezählerausrüstung verwenden.
Die zulässigen Werte pro ml Probe können je nach den Vorschriften, für die sie gelten, von Land zu Land unterschiedlich sein..
-Berechnung der KBE
Die allgemeine Berechnung erfolgt nach folgender Formel:

Drücken Sie die Ergebnisse in 1 oder 2 Ziffern aus und multiplizieren Sie sie mit der entsprechenden Basis 10. Beispiel: Wenn das Ergebnis 16.545 ist, wird es basierend auf der dritten Ziffer auf 17.000 gerundet und wie folgt ausgedrückt: 1,7 x 104. Wenn das Ergebnis 16.436 wäre, runden Sie es auf 16.000 und drücken Sie 1,6 x 10 aus4.
Oberflächen-Seeding-Technik
-Prozess
-Mit 0,1 ml der direkten Probe beimpfen, wenn diese flüssig ist, anfängliche Suspension 10-1 oder 10 aufeinanderfolgende Verdünnungen-zwei, 10-3 usw. in der Mitte einer Standard-Zählagarplatte.
-Verteilen Sie die Probe gleichmäßig mit einem Drigalski-Spatel oder einem L-förmigen Glasstab und lassen Sie sie 10 Minuten lang stehen.
-Platten umdrehen und 24 bis 48 Stunden bei 37 ° C aerob inkubieren.
-Fahren Sie mit der Zählung der Kolonien fort und wählen Sie die Platten aus, die sich in einem Bereich zwischen 20 und 250 KBE befinden.
-Berechnung der KBE
Für die Berechnung wird der Verdünnungsfaktor angewendet, der umgekehrt ist. Die Zahl wird auf 2 signifikante Stellen gerundet (Rundung gemäß der dritten Ziffer) und in Potenz der Basis 10 ausgedrückt. Wenn beispielsweise 224 KBE in der Probe ohne Verdünnung gezählt werden (10)-1) Werden 22 x 10 gemeldet1 UFC, aber wenn die Zahl 225 wäre, wird es 23 x 10 gemeldet1 UFC.
Wenn Sie nun 199 KBE in Verdünnung 10 zählen-3, wird 20 x 10 gemeldet4 KBE, aber wenn 153 KBE in derselben Verdünnung gezählt werden, werden 15 x 10 gemeldet4 UFC.
QA
Das Standard-Zählkulturmedium kann unter Verwendung zertifizierter bekannter Stämme bewertet werden, wie z. Escherichia coli ATCC 8739, Staphylococcus aureus ATCC 6538, Bacillus subtilis ATCC 6633, Lactobacillus fermentum ATCC 9338, Staphylococcus epidermidis ATCC 12228, Shigella flexneri ATCC 12022.
Wenn sich das Kulturmedium unter optimalen Bedingungen befindet, wird in allen Fällen ein zufriedenstellendes Wachstum erwartet, mit Ausnahme von L. fermentum das kann eine regelmäßige Leistung haben.
Um die Sterilität des Kulturmediums zu bewerten, sollten eine oder zwei Platten jeder hergestellten Charge (ohne Inokulation) 24 Stunden bei 37 ° C in Aerobiose inkubiert werden. Nach dieser Zeit sollte kein Wachstum oder Farbwechsel des Mediums beobachtet werden..
Einschränkungen
-Schmelzen Sie den Agar nicht mehr als einmal.
-Das vorbereitete Medium kann bis zu 3 Monate halten, solange es im Kühlschrank aufbewahrt und vor Licht geschützt wird..
-Dieses Medium ist nicht für anspruchsvolle oder anaerobe Mikroorganismen geeignet.
Verweise
- Nationale Verwaltung für Arzneimittel, Lebensmittel und Medizintechnik (ANMAT). Mikrobiologische Analyse von Lebensmitteln, offizielle Analysemethode, Indikatormikroorganismen. 2014 Band 3. Verfügbar unter: anmat.gov.ar
- Laboratorien Difco Francisco Soria Melguizo, S.A. Tellerzähl-Agar. 2009. Verfügbar unter: http://f-soria.es
- Conda Pronadisa Laboratories. Standard Method Agar (PCA) gemäß APHA und ISO 4833. Verfügbar unter: condalab.com
- Britannia Laboratories. Agar Tellerzahl. 2015. Verfügbar unter: britanialab.com
- Camacho A, Giles M, Ortegón A, Palao M, Serrano B und Velázquez O. 2009. Techniken zur mikrobiologischen Analyse von Lebensmitteln. 2nd ed. Fakultät für Chemie, UNAM. Mexiko. Verfügbar unter: depa.fquim.unam



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.