
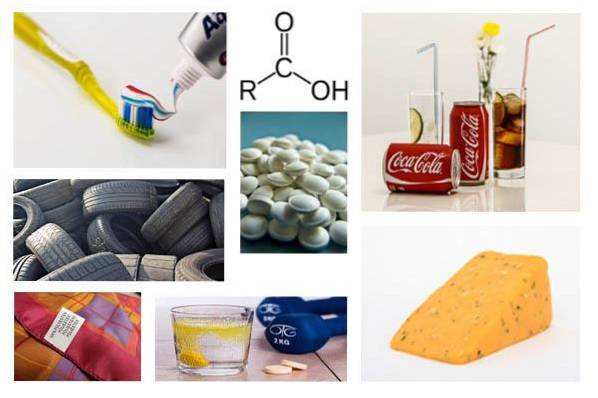
30 Verwendung von Carbonsäuren im Alltag

Das Verwendung von Carbonsäuren Sie sind so umfangreich, dass sie in verschiedene Branchen unterteilt werden können, z. B. Pharmazeutika (zur Herstellung von Arzneimitteln auf Vitamin C-Basis) oder Lebensmittel (Herstellung von Erfrischungsgetränken, Herstellung von Zusatzstoffen).
Carbonsäuren sind im Wesentlichen organische Säuren, deren Komponenten eine Carboxylgruppe aufweisen, die an eine Alkyl- oder Arylgruppe gebunden ist. Sie werden in einer chemischen Formel wie folgt dargestellt: COOH, und ihr Name beruht auf der Konjugation oder Kombination von Carbonyl (C = O) und Hydroxyl.
Wenn die Kohlenstoffkette nur eine Carboxylgruppe aufweist, werden die Säuren als Monocarbonsäure oder Fettsäuren bezeichnet, während die Säuren als Dicarbonsäure bezeichnet werden, wenn sie zwei Carboxylgruppen aufweist..
Sie werden auch als organische Säuren bezeichnet und sind normalerweise "schwache" Säuren, wobei nur 1% der RCOOH-Moleküle in Ionen dissoziiert sind (bei Raumtemperatur und in einer wässrigen Lösung)..
Sie sind schwächere Säuren als Mineralsäuren wie Salzsäure oder Schwefelsäure. Sein Säuregehalt ist jedoch höher als der von Alkoholen.
Sie sind polare Substanzen, die Wasserstoffbrückenbindungen untereinander oder mit den Molekülen einer anderen Substanz eingehen.
Was sind die Hauptanwendungen von Carbonsäuren?
Carbonsäuren kommen auf natürliche Weise in Fetten, sauren Milchprodukten und Zitrusfrüchten vor. Ihre wichtigsten Verwendungszwecke sind:
Nahrungsmittelindustrie
1- Zusatzstoffe.
2- Konservierungsmittel (Sorbinsäure und Benzoesäure).
3- Alkalitätsregler vieler Produkte.
4- Herstellung von Erfrischungsgetränken.
5- Antimikrobielle Mittel vor der Wirkung von Antioxidantien. In diesem Fall geht der Trend zu flüssigen antimikrobiellen Mitteln, die die Bioverfügbarkeit ermöglichen..
6- Hauptbestandteil von gewöhnlichem Essig (Essigsäure).
7- Säuerungsmittel in kohlensäurehaltigen Getränken und Lebensmitteln (Zitronensäure und Milchsäure).
8- Helfer bei der Reifung von Schweizer Käse (Propionsäure).
9- Käse, Sauerkraut, fermentierten Kohl und alkoholfreie Getränke (Milchsäure) herstellen.
Pharmaindustrie
10- Antipyretikum und Analgetikum (Acetylsalicylsäure).
11- Aktiv bei der Synthese von Aromen in einigen Arzneimitteln (Buttersäure oder Butansäure).
12- Antimykotikum (Benzoesäure kombiniert mit Salicylsäure).
13- Aktiv zur Herstellung von Arzneimitteln auf der Basis von Vitamin C (Ascorbinsäure).
14- Fungizid (Caprylsäure).
15- Herstellung einiger Abführmittel (Hydroxybutandisäure).
Andere Branchen
16- Herstellung von Kunststoffen und Schmiermitteln (Sorbinsäure).
17- Herstellung von Lacken, elastischen Harzen und transparenten Klebstoffen (Acrylsäure).
18- Herstellung von Farben und Lacken (Linolsäure).
19- Herstellung von Seifen, Waschmitteln, Shampoos, Kosmetika und Metallreinigungsmitteln (Ölsäure).
20- Herstellung von Zahnpasta (Salicylsäure).
21- Herstellung von Rayonacetat, fotografischen Filmen und Lösungsmitteln für Farben (Essigsäure).
22- Herstellung von Farbstoffen und Gerbung (Methansäure).
23- Herstellung von Schmierölen, wasserfesten Materialien und Farbtrocknern (Palmitinsäure).
24- Herstellung von Gummi (Essigsäure).
25- Ausarbeitung von Gummi und beim Galvanisieren.
26- Lösungsmittel.
27- Herstellung von Parfums (Benzoesäure).
28- Herstellung von Weichmachern und Harzen (Phthalsäure).
29- Herstellung von Polyester (Terephthalsäure).
30- Herstellung von Paraffinkerzen (Stearinsäure).
In der Landwirtschaft werden sie häufig auch verwendet, um die Qualität von Obstpflanzen zu verbessern, die Menge und das Gewicht der Früchte in einigen Pflanzen sowie deren Aussehen und Dauer nach der Ernte zu erhöhen..
Carbonsäuren sind in den Fortschritten der experimentellen und biochemischen Chemie sehr präsent, insbesondere in Bezug auf die Fermentation, die für die Herstellung verschiedener Produkte von kommerziellem Interesse erforderlich ist (unter anderem Antibiotika, organische Lösungsmittel und Vitamine)..
Eigenschaften von Carbonsäuren
Einige Eigenschaften dieser Chemikalien sind:
Löslichkeit
Die ersten vier aliphatischen Monocarbonsäuren sind flüssig und wasserlöslich.
Diese Eigenschaft nimmt ab, wenn die Anzahl der Kohlenstoffatome zunimmt, so dass sie aus Dodecansäure in Wasser unlöslich werden.
Siedepunkt
Der Siedepunkt dieser Substanzen ist aufgrund des Vorhandenseins einer doppelten Wasserstoffbindung zwischen ihren Komponenten hoch..
Schmelzpunkt
Dies ist eine Eigenschaft, die je nach Menge der Kohlenstoffe variiert, da diese die Assoziation zwischen Molekülen beeinflussen.
Ab 6 Kohlenstoffen beginnt ein unregelmäßiger Anstieg des Schmelzpunktes.
Verweise
- Abreu Payrol, Juan & andere (2001). Carbonsäuren aus der Frucht von Bromelia pinguin L. (Mausananas) mittels HPLC. Cuban Journal of Pharmacy, 35 (2), 122-125. Wiederhergestellt von: scielo.sld.cu.
- Binod, Shrestha (2010). Verwendung von Carbonsäure. Wiederhergestellt von: chem-guide.blogspot.com.
- Netto, Rita (2011). Organische Säuren im Alltag vorhanden. Wiederhergestellt von: alimentacion.en Emphasis.com.
- Hauptcarbonsäuren und ihre Anwendungen. Wiederhergestellt von: quiminet.com.
- Rank, J. (s / w). Carbonsäuren - industrielle Bedeutung - Fett, Ester, organisch und löslich. Wiederhergestellt von: science.jrank.org.
- Requena, L. (2001). Wir werden organische Chemie studieren. Héctor A. García Bildungsstiftung. Wiederhergestellt von: salonhogar.net.
- Román Moreno, Luís F. (1998). Bewertung von Carbonsäuren und Calciumnitrat zur Erhöhung von Qualität, Quantität und Haltbarkeit bei drei Melonentypen im Journal Terra Latinoamericana 1998 16 (1). Wiederhergestellt von: redalyc.org.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.