
Wrights Gründe, Materialien, Techniken und Verwendungszwecke für Flecken

Das Wright Fleck ist eine Färbetechnik, die 1902 vom amerikanischen Pathologen James Homer Wright basierend auf der Romanowsky-Färbung entwickelt wurde. Da der Romanowsky-Fleck instabil war, baute Wright Methanol als Lösungsmittel und Fixiermittel ein..
Diese Färbung ist polychromatisch, was bedeutet, dass abhängig von der Struktur, die den Farbstoff absorbiert, mehrere Farben erzeugt werden. Diese Färbetechnik wurde häufig verwendet, um unterschiedliche Leukozytenzahlen durchzuführen und die Morphologie von roten Blutkörperchen, Blutplättchen und Leukozyten in peripherem Blut und Knochenmark zu untersuchen..
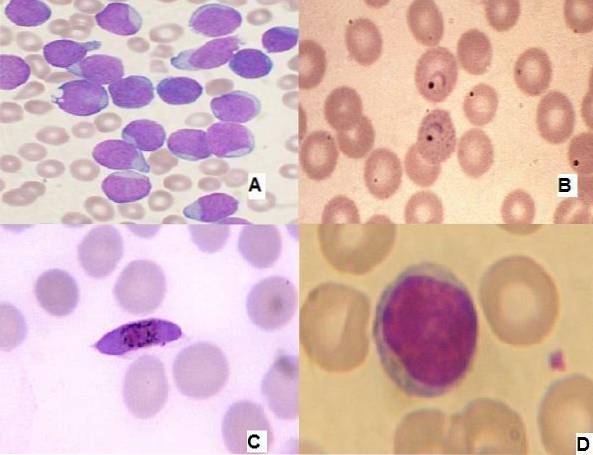
Seine Anwendung ist sehr wichtig, da Anomalien in den verschiedenen Zelllinien des Blutes auftreten können, was die Diagnose von Krankheiten wie Leukämie oder bakteriellen oder parasitären Infektionen erleichtert..
Vielleicht sind dies die häufigsten Anwendungen, in denen diese Technik verwendet wird, aber sie sind nicht die einzigen. Es ist auch nützlich in anderen Proben als Blut und Knochenmark, wie z. B. Nasenausfluss, Stuhlschleim, Auswurf, Hautproben, unter anderem..
Artikelverzeichnis
- 1 Begründung für Wrights Fleck
- 2 Materialien
- 2.1 Vorbereitung
- 2.2 Pufferlösung
- 2.3 Zusätzliche Materialien, die zur Durchführung der Färbung benötigt werden
- 3 Komponenten von Wrights Fleck
- 3.1 Methanol
- 3.2 Der Dämpfer
- 3,3 Eosin (Y)
- 3.4 Methylenblau
- 4 Technik
- 5 Dienstprogramm
- 5.1 Hämatologie
- 5.2 Nasenausfluss
- 5.3 Parasitologie
- 5.4 Infektionen der Atemwege
- 5.5 Bakteriologie
- 5.6 Mykologie
- 6 Wie werden die Strukturen der Blutprobe mit der Wright-Färbung beobachtet??
- 7 Empfehlungen für eine gute Färbung
- 8 Häufige Fehler bei der Wright-Färbung
- 8.1 Sehr blasse Färbung
- 8.2 Farbstoff fällt aus
- 8.3 Abstriche mit extrem rötlicher oder blauer Färbung
- 9 Speichermodus
- 10 Referenzen
Begründung für Wrights Fleck
Der Wright-Farbstoff wurde aus dem Romanowsky-Farbstoff geboren, der aus einer Methylalkohollösung eines sauren Farbstoffs (Eosin Y) und eines basischen Farbstoffs (Methylenblau) und deren Oxidationsprodukten besteht..
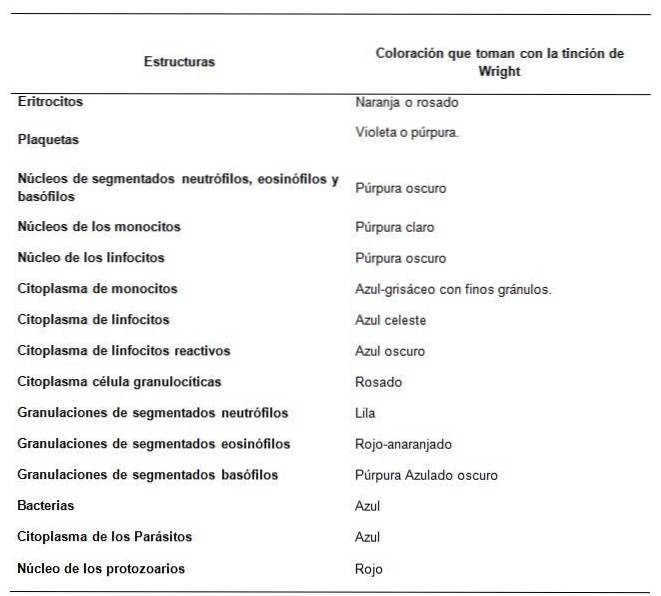
Die in Wrights Färbung verwendete Farbstoffmischung bewirkt den als Romanowsky bekannten Effekt, dh sie verleiht den Kernen von Leukozyten und neutrophilen Granulaten eine schöne violette Färbung, während die roten Blutkörperchen rosa färben..
Die Komponenten, die für die typische Farbskala der Wright-Färbung verantwortlich sind, sind Blau B und Eosin Y. Der beobachtete Effekt hängt von der Bindung der Farbstoffe an chemische Strukturen und den Wechselwirkungen von Blau B und Eosin Y ab.
Saure Strukturen wie Nukleinsäuren, Kernproteine und das reaktive unreife Zytoplasma einiger Zelltypen fixieren Blau B (Grundfärbung)..
Während Grundstrukturen wie Hämoglobin das Granulat segmentierter Eosinophiler neben anderen Zellstrukturen Eosin Y (Säurefarbstoff) binden.
Das Färbeergebnis kann durch verschiedene Faktoren beeinflusst werden, wie den pH-Wert des Wright-Farbstoffs, des Puffers und der Waschlösung; sowie die Färbe- und Fixierungszeit.
Daher ist jeder Schritt bei der Herstellung der Reagenzien von entscheidender Bedeutung und muss unter Berücksichtigung aller Details durchgeführt werden..
Materialien
Wrights Fleck. Für 100 ml ist Folgendes erforderlich:
0,3 g Wright-Färbung abwiegen, 97 ml Methanol und 3 ml Glycerin abmessen.
Vorbereitung
In einen Mörser die große Menge an Wright-Fleck geben und das Glycerin allmählich einarbeiten, bis sich das Pulver vollständig aufgelöst hat..
Anschließend wird das Methanol zugegeben, gemischt und in eine Bernsteinflasche gegossen.
Vor dem Gebrauch sollte die Lösung mit leichten Bewegungen geschüttelt und gefiltert werden.
Gepufferte Pufferlösung
In einen Liter destilliertes Wasser werden 3,76 g Dinatriumhydrophosphat (Na) gegebenzweiHPO4 2Hzwei0) plus 2,1 g Dihydrogen Kaliumphosphat (KHzweiPO4).
Sehr gut mischen, bis alle eingearbeiteten Reagenzien gelöst sind. Stellen Sie den pH auf 7,2 ein. In ein Glas gießen und bei Raumtemperatur aufbewahren.
Zusätzliche Materialien für die Färbung
Zusätzlich sind andere Materialien erforderlich, um die Färbetechnik ausführen zu können. Dies sind: Objektträger oder Abdeckungsobjekte, Farbbrücke, T-Shirts mit Wasser oder Puffer zum Waschen, eine Stoppuhr zur Einhaltung der Färbezeiten und etwas Löschmaterial. (saugfähiges Papier, Mull oder Baumwolle).
Bestandteile von Wrights Fleck
Methanol
Alkohol (Methanol) dient als Fixiermittel für den Blutausstrich auf dem Objektträger.
Es ist im Grunde ein reduzierendes, dehydratisierendes und koagulierendes Fixiermittel. Daher besteht seine Funktion darin, Proteine zu koagulieren und unlöslich zu machen, ohne sie jedoch tatsächlich zu denaturieren..
Methanol ist das in allen Labors am häufigsten verwendete Abstrichfixierungsreagenz, da es bessere Ergebnisse liefert als Ethanol. Die ideale Konzentration beträgt 99%.
Dämpfer
Der Puffer (gepufferte Lösung) hat die Funktion, den pH-Wert des Farbstoffs einzustellen oder aufrechtzuerhalten, da ein auf 7,2 eingestellter pH-Wert wesentlich ist, damit die Zellstrukturen die Farbstoffe richtig absorbieren können..
Andererseits entwässert der Methanol-Fixierungsschritt die Zellen und der Puffer hilft, sie zu rehydrieren..
Eosin (Y)
Eosin hat eine Affinität zu Bausteinen, da es ein saurer Farbstoff ist. Zwei Arten von Eosin sind einander sehr ähnlich, so dass beide verwendet werden können, um das gleiche Ergebnis zu erzielen..
Eines heißt Eosin Y, gelbes Eosin oder Tetrabromfluorescein, und das andere heißt Eosin B, bläuliches Erythrosin B oder Dibromdinitrofluorescein. Am häufigsten wird jedoch Eosin Y verwendet.
Die wichtigste Eigenschaft dieses Farbstoffs ist seine negative Polarität, wodurch er von positiv geladenen Zellstrukturen angezogen wird.
Methylenblau
Es ist die Grundfarbe. Seine Haupteigenschaft ist die Metachromasie, dh nicht alle Strukturen werden gleich gefärbt, sondern es hängt von der chemischen Zusammensetzung der Strukturen ab, die gefärbt werden..
Einige werden hell oder dunkelblau und andere dunkelviolett oder blass lila.
Technik
1-Führen Sie die Verteilung der Probe so durch, dass ein dünner Film entweder auf einem Objektträger oder einem Deckglas verbleibt.
2-Lassen Sie es ca. 2 Stunden an der Luft trocknen.
3-Legen Sie den trockenen Abstrich mit der Ausbreitung der Probe nach oben auf die Färbebrücke oder die Färbeschale..
4-Bedecken Sie das Blatt tropfenweise mit dem Wright-Fleck, bis die gesamte Oberfläche bedeckt ist. 5 - 8 Minuten einwirken lassen.
5-Der Fleck sollte den Objektträger vollständig bedecken, ohne über die Kanten zu gelangen. Wenn es während der Färbezeit zu verdampfen beginnt, fügen Sie einige zusätzliche Tropfen hinzu.
6-Fügen Sie anschließend eine gleiche Menge des Stoßdämpfers hinzu und blasen Sie ein wenig, bis der charakteristische metallische Glanz erscheint. Timing 10 bis 15 Minuten.
7-Waschen Sie mit Leitungswasser und platzieren Sie den sanften Strahl, bis das Blatt rosa aussieht.
8-Entfernen Sie mit einer mit Alkohol imprägnierten Gaze den Farbstoff, der auf der Rückseite des Objektträgers haftet.
9-Lassen Sie den Abstrich sehr gut trocknen, bevor Sie das Immersionsöl einsetzen, um es unter dem Mikroskop zu betrachten.
Nützlichkeit
Hämatologie
Es ist ideal zur Färbung von peripheren Blutausstrichen, zur Untersuchung von dicken Blutausstrichen und zur Untersuchung von Zellen aus Knochenmarksproben.
Aufgrund der chemischen Eigenschaften dieser Farbstoffkombination können Zellstrukturen leicht erkannt werden, wodurch die verschiedenen vorhandenen Zelltypen unterschieden werden können.
Laufende Nase
Diese Technik ist sehr nützlich, um die Zellen des Nasenausflusses (Epithelzellen, segmentierte Eosinophile, polymorphkernige Zellen) bei der Diagnose einer allergischen Rhinitis zu identifizieren..
Parasitologie
In diesem Sinne war es nützlich für das Studium von Leishmania sp innerhalb der Histiozyten des subkutanen Zellgewebes bei Hautgeschwüren. Ebenso wird es verwendet, um Leukozyten in Stuhlproben zu identifizieren (Stuhlleukogramm).
In diesem Fall ist es für den Arzt von Interesse zu wissen, ob die im Stuhl vorhandene Leukozytose polymorphkernig oder einkernig ist. Dieser Befund im Stuhlleukogramm gibt Aufschluss darüber, ob es sich um eine bakterielle oder eine virale Infektion handelt..
Andererseits können im Blut zirkulierende Parasiten im Erythrozyten oder frei im Plasma gefunden werden. Die gesuchten Parasiten sind Plasmodium spp., Trypanosoma cruzii und Filarien, und in der Veterinärmedizin ist es nützlich bei der Suche nach Theileria equi Y. Babesia caballi, Erreger der Bebesiose, insbesondere bei Pferden.
Die Wright-Färbung und auch die Giemsa-Färbung ermöglichen es, Hämoparasiten von normalen Zellbestandteilen zu unterscheiden. Hierfür können zwei Arten von Spreads verwendet werden:
Verbreitet sich gut
Blut wird als dünner Film auf einem Objektträger verteilt. Mit Wright-Färbung gefärbt, wobei die Eigenschaften des Kerns und des Zytoplasmas sichtbar werden.
Dicker Tropfen
Diese Methode wird verwendet, um das Vorhandensein von Parasiten in einer größeren Menge Blut zu untersuchen..
Dazu wird ein großer Blutstropfen auf einen Objektträger gegeben. Dort muss es defibrilliert werden und mit der Kante eines anderen Objektträgers immer größere Kreise von der Mitte nach außen bilden..
Schließlich müssen die Erythrozyten mit Wasser lysiert werden, um die Parasiten im dicken Abstrich beobachten zu können..
Infektionen der Atemwege
Auf der Ebene der Atemwege ist diese Technik auch nützlich, da die in den Proben von Sputum, Bronchialspülung oder Bronchoalveolar vorhandenen Zellen wichtig sind, um die Diagnose zu stellen..
In ähnlicher Weise können hier polymorphkernige Zellen und mononukleäre Zellen unterschieden werden..
Bakteriologie
Die Verwendung dieser Technik in der Bakteriologie ist begrenzt, da sie nicht zum Färben von Bakterien geeignet ist, weshalb andere spezialisierte Färbetechniken zum Färben dieser Bakterien verwendet werden..
Es wurde jedoch verwendet, um nach Epithelzellen mit Einschlusskörpern von zu suchen Chlamydia trachomatis bei Abstrichen der Harnröhren- oder Endozervixschleimhaut, obwohl anerkannt werden muss, dass dies nicht die beste Methode dafür ist.
Es ist auch möglich, spiralförmige Bakterien wie z Borrelia burgdorferi bei infizierten Patienten sowie Morulae oder Einschlusskörper von Ehrlichia sp im Zytoplasma von Lymphozyten, Monozyten oder Neutrophilen in einem Blutausstrich.
Pilzkunde
Das Histoplasma capsulatum ist ein pathogener Pilz, der häufig durch mikroskopische Beobachtung verschiedener Gewebeproben diagnostiziert wird und mit Wright-Färbung gefärbt ist.
Wie werden die Strukturen der Blutprobe mit der Wright-Färbung beobachtet??
Empfehlungen für eine gute Färbung
Die Abstriche von Blutproben sollten spontan an der Luft trocknen. Die Abstriche sollten so dünn wie möglich sein, um eine bessere Fixierung des Farbstoffs zu erzielen und eine Überfärbung zu vermeiden..
Für eine qualitativ hochwertige Färbung ist es ratsam, innerhalb von zwei Stunden nach der Abstrichvorbereitung zu färben. Andererseits ist Kapillarblut ohne Antikoagulans die ideale Probe.
Wenn jedoch venöses Blut verwendet wird, sollte es als Antikoagulans EDTA und nicht als Heparin verwendet werden, da letzteres die Zellstrukturen deformieren kann.
Um eine Verschlechterung des vorbereiteten Farbstoffs zu vermeiden, sollte es an trockenen Orten gelagert werden.
Während des Waschvorgangs wird die Verwendung von Wasser empfohlen, das auf einen neutralen pH-Wert eingestellt ist..
Schließlich ist es ratsam, die im Labor verwendeten Färbemethoden von Zeit zu Zeit zu testen..
Dies erfolgt durch Färben von Proben oder erweiterten Mustern als Qualitätskontrolle. Dieser Schritt ist wichtig, da er sicherstellt, dass die Färbung richtig vorbereitet ist und die Färbezeiten gut standardisiert sind..
Wenn das Musterblatt schlecht gefärbt ist, müssen Probleme gelöst werden..
Häufige Fehler bei der Wright-Färbung
Sehr blasse Färbung
Sehr blasse Abstriche sind normalerweise auf eine sehr kurze Färbezeit oder übermäßiges Waschen zurückzuführen. Sie wird korrigiert, indem die Kontaktzeit mit dem Farbstoff verlängert oder die Waschzeit verkürzt wird.
Farbstoff fällt aus
Das Vorhandensein von Farbstoffniederschlägen im Abstrich kann mehrere Ursachen haben. Die häufigsten Ursachen sind jedoch: Verwendung von ungefiltertem Farbstoff, Verfärbung auf unebenen Färbebrücken, Verwendung von mit Staub oder Fett verschmutzten Folien, nicht gut gewaschene Endverfärbung.
Extrem roter oder blauer Abstrich
Der Puffer ist für den pH-Wert des Farbstoffs verantwortlich. Farbstoffe mit einem pH-Wert unter dem angegebenen (sauer) führen zu sehr rötlichen Abstrichen..
Wenn der pH-Wert des Farbstoffs über (alkalisch) liegt, wird ein extrem bläulicher Abstrich erhalten.
Speichermodus
Das Reagenz sollte bei Raumtemperatur gelagert werden.
Verweise
- Gutiérrez V. Vergleichende Studie zwischen der Wright-Färbemethode und dem Elisa-Test zur Diagnose der Ehrlichiose bei Hunden in der Stadt San Pedro Sula, Honduras. 2008. Diplomarbeit zur Qualifikation zum Tierarzt. Universität von San Carlos von Guatemala.
- López-Jácome L., Hernández-Durán M., Colín-Castro C., Ortega-Peña S., Cerón-González G., Franco-Cendejas F. Grundfärbungen im mikrobiologischen Labor. Forschung in Behinderung. 2014; 3 (1): 10-18.
- "Wrights Fleck." Wikipedia, die freie Enzyklopädie. 18. Mai 2018, 12:05 UTC. 8. Dezember 2018, 20:37
- Calderón A, Cardona J, Vergara Ó. Frequenz von Babesia spp. auf montería Pferden, Córdoba (Kolumbien). Rev. udcaactual divulg cient. 2013; 16 (2): 451 & ndash; 458.
- Forbes B, Sahm D, Weißfeld A (2009). Bailey & Scott Mikrobiologische Diagnose. 12 ed. Argentinien. Editorial Panamericana S.A..
- Retamales E, Mazo V. Regierung des chilenischen Instituts für öffentliche Gesundheit. Empfehlungen zum Färben von Blutausstrichen zum Ablesen des Blutbildes.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.