
Postulate und Fehler des Dalton-Atommodells

Das Daltons Atommodell oder Daltons Atomtheorie, Es war ein Vorschlag, der zwischen 1803 und 1807 vom englischen Chemiker und Mathematiker John Dalton vorgelegt wurde. Dies war der erste Vorschlag für eine konzeptionelle Organisation hinsichtlich der Struktur und Funktionsweise von Atomen..
Daltons Modell ist auch als sphärisches Modell bekannt, da es die Tatsache vorschlägt, dass das Atom eine unteilbare, feste und kompakte Kugel ist. Dieses Modell machte es viel einfacher, dem Rest der Welt die Chemie zu erklären, und es war die Grundlage für die vielen innovativen Forschungsprojekte, die folgten. Es konnte erklärt werden, warum Substanzen in bestimmten Zuständen reagierten.
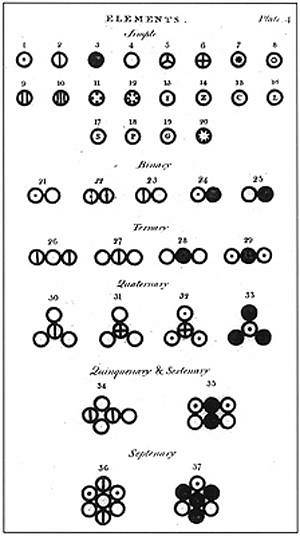
Nach Dalton bestand die Materie aus einer minimalen Einheit, die als Atom bezeichnet wurde und in keiner Weise zerstört oder geteilt werden konnte. Diese Einheit, die früher von Demokrit und seinem Mentor Leucippus vorgeschlagen wurde, war die Grundlage für Daltons Forschung und die Schaffung seines Atommodells..
Mit dieser Atomtheorie versuchte John Dalton, die Ideen der griechischen Philosophen über die Existenz des Atoms (Atomtheorie des Universums) aufzugreifen, nutzte jedoch verschiedene Laborexperimente als Plattform, um seine Ideen zu demonstrieren..
Artikelverzeichnis
- 1 Postulate von Daltons Atommodell
- 1.1 Postulat 1
- 1.2 Postulat 2
- 1.3 Postulat 3
- 1.4 Postulat 4
- 1.5 Postulat 5
- 1.6 Postulat 6
- 2 Fehler von Daltons Atommodell
- 2.1 Wasserformel
- 2.2 Zusammensetzung der Atome
- 3 Schlussfolgerungen
- 4 Hauptbeiträge von Dalton
- 4.1 Vorläufer der Atomtheorien
- 4.2 Grundlagen der modernen Chemie gelegt
- 4.3 Zuerst eine Tabelle mit chemischen Gewichten veröffentlichen
- 4.4 Farbenblindheit benennen
- 5 Artikel von Interesse
- 6 Referenzen
Dalton-Atommodell-Postulate
Dalton formulierte sein Atommodell mit 6 Postulaten, in denen er erklärt, worauf er seine Studien stützte und wie er sie durchführte.
Postulat 1

Im oberen Bild ist eine Zusammenfassung von Daltons Modell dargestellt: Die Atome wären unteilbare, unzerstörbare und homogene winzige Kugeln.
Daltons erstes Postulat stellte fest, dass Elemente aus winzigen Teilchen bestehen, die Atome genannt werden und weder geteilt noch zerstört werden können..
Ebenso bemerkte Dalton, dass sich diese Partikel bei keiner chemischen Reaktion ändern könnten.
Postulat 2

Daltons zweites Postulat stellte fest, dass alle im selben Element vorhandenen Atome sowohl im Gewicht als auch in anderen Eigenschaften gleich sind.
Andererseits wurde auch festgestellt, dass die Atome verschiedener Elemente unterschiedliche Massen haben. Aus diesem Vorschlag ergab sich die Kenntnis der relativen Atomgewichte, die beim Vergleich verschiedener Elemente mit Wasserstoff nachgewiesen wurden..
Postulat 3

Daltons drittes Postulat besagte, dass Atome selbst dann unteilbar sind, wenn sie in chemischen Reaktionen kombiniert werden. Sie können auch nicht geschaffen oder zerstört werden.
Die Kombination gleicher und unterschiedlicher Atome erzeugt komplexere Verbindungen, aber dieser Prozess ändert nichts an der Tatsache, dass das Atom die kleinste Einheit der Materie ist..
Postulat 4
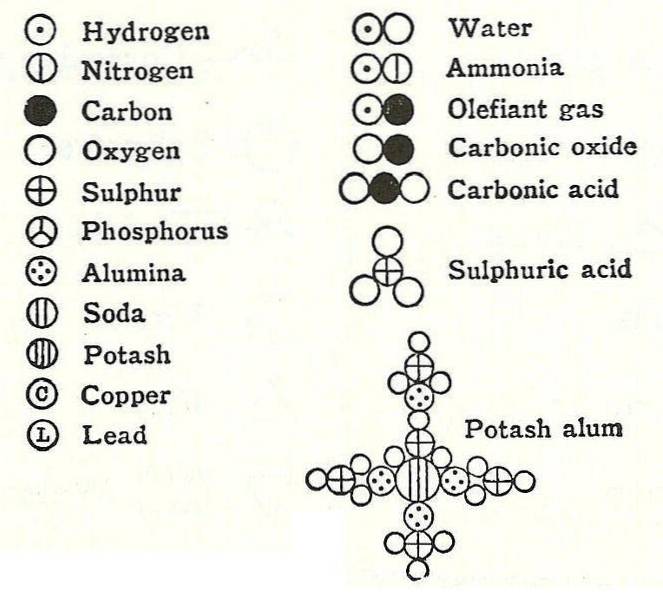
Daltons viertes Postulat stellte fest, dass Atome, selbst wenn sie sich zu einer Verbindung verbinden, immer eine Beziehung haben, die in einfachen und vollständigen Zahlen ausgedrückt werden kann. Dieser Ausdruck wird nicht in Brüchen angezeigt, da die Atome unteilbar sind.
Postulat 5
Daltons fünftes Postulat stellte fest, dass es die mögliche Kombination verschiedener Atome in unterschiedlichen Anteilen gibt, um mehr als eine Verbindung zu bilden..
Auf diese Weise könnte erklärt werden, dass die gesamte im Universum vorhandene Materie aus einer endlichen Anzahl von Atomen stammt..
Postulat 6
Daltons sechstes und letztes Postulat stellte fest, dass jede chemische Verbindung aus der Kombination der Atome von zwei oder mehr verschiedenen Elementen hergestellt wurde..
Dalton-Atommodellfehler
Wie bei jeder Theorie in der Welt der Wissenschaft gab es viele Widerlegungen bezüglich des von Dalton vorgeschlagenen Modells, die im Laufe der Jahre demonstriert wurden und Daltons innovative Ideen hinterließen..
Wasserformel
Ein Beispiel dafür war das Argument von Dalton über die Formel des Wassers, das seiner Meinung nach aus einem Wasserstoff und einem Sauerstoff bestand.
Aufgrund dieser Aussage gab es viele Berechnungsfehler hinsichtlich der Masse und des Gewichts einiger basischer Verbindungen, die auf diesen Informationen basierten..
Einige Jahre später widerlegten die europäischen Wissenschaftler Gay-Lussac und Alexander von Humbodt diese Information und zeigten, dass Wasser tatsächlich aus zwei Wasserstoffatomen und einem Sauerstoff bestand. 6 Jahre später spezifizierte Amadeo Avogadro die genaue Zusammensetzung des Wassers und deshalb gibt es das Avogadro-Gesetz.
Zusammensetzung der Atome
Andererseits wurde im 20. Jahrhundert die wahre Zusammensetzung der Atome offenbart. In diesem Fall wurde gezeigt, dass es eine kleinere Einheit wie Protonen, Elektronen und Neutronen gibt.
Ebenso kamen die Existenz der verschiedenen Atomgewichte im Periodensystem von Mendeleev und Meyer, die Existenz von Isotopen und die spezifischeren chemischen Eigenschaften zum Vorschein..
Schlussfolgerungen
Trotz seiner Fehler waren John Daltons Beiträge in der Welt der Wissenschaft von großer Relevanz und sorgten aufgrund der großen Menge an Informationen, die er zur Verfügung stellte, für Aufsehen in seiner Zeit.
Seine wissenschaftlichen Beiträge sind immer noch gültig und werden noch heute untersucht..
Daltons Atommodell wurde aufgrund seiner Relevanz für die Welt der Wissenschaft und seiner genauen Erklärung der Untersuchungen und Hypothesen, die zu dieser Zeit in der Geschichte der Wissenschaft vorgestellt wurden, jahrzehntelang nicht in Frage gestellt..
Daltons Hauptbeiträge
Sein Beitrag zur Welt der Wissenschaft bestand hauptsächlich darin, Hypothesen über die Natur durch quantitative Tests zu klären und zu formulieren.
Der Wissenschaftler starb am 27. Juli 1884 in Manchester an einem Herzinfarkt und wurde kurz darauf von der Monarchie geehrt.
Vorläufer der Atomtheorien
John Dalton war ein englischer Chemiker, Mathematiker und Naturforscher. Er wurde am 6. September 1766 in Cumberland, Großbritannien, geboren und gilt seit seiner Vorstellung seines Atommodells als einer der Vorläufer der Atomtheorien.
Grundsteinlegung für die moderne Chemie
Dalton ist als einer der Vorreiter bei der Erstellung einer Tabelle mit relativen Gewichten für chemische Elemente bekannt. Diese Tatsache trug dazu bei, den Grundstein für das zu legen, was wir heute als moderne Chemie kennen..
Zuerst eine Tabelle mit chemischen Gewichten veröffentlichen
Dalton war der erste Wissenschaftler, der die Ehre hatte, eine Tabelle mit Atomgewichten zu veröffentlichen, die Elemente wie Wasserstoff, Sauerstoff, Phosphor, Kohlenstoff und Schwefel enthielt. Dank dieser Veröffentlichung begann Dalton zu arbeiten und sein Atommodell zu formen.
Farbenblindheit benennen
Es sollte beachtet werden, dass Dalton einer der ersten aufgezeichneten Personen mit Sehproblemen war, die Farben einfingen, und wegen ihm wird dieser Zustand als Farbenblindheit bezeichnet.
Artikel von Interesse
Schrödingers Atommodell.
Atomic de Broglie Modell.
Chadwick-Atommodell.
Heisenberg-Atommodell.
Perrins Atommodell.
Thomsons Atommodell.
Dirac Jordan Atommodell.
Atommodell von Demokrit.
Atommodell von Leukipp.
Bohr-Atommodell.
Rutherford-Atommodell.
Aktuelles Atommodell.
Verweise
- Daltons Atomtheorie. Abgerufen am 24. November 2017 von der Khanacademy: www.khanacademy.org
- Daltons Atomtheorie. Abgerufen am 24. November 2017 von der Indiana University Northwest: iun.edu
- Atomtheorie. Abgerufen am 24. November 2017 von Encyclopædia Britannica: www.britannica.com
- Atomtheorie. Abgerufen am 24. November 2017 von Wikipedia: en.wikipedia.org
- Geschichte der Atomstruktur. Abgerufen am 24. November 2017 von Lumen: Kurse.lumenlearning.com.

essay writing help online <a href=https://geniusessaywriters.net>definition essay help</a> mba admission essay writing service
custom essay company <a href=https://firstessayservice.net>buying essays online</a> buy custom essays
history essay writing service <a href=https://customs-essays-writing.org>help with writing college essays</a> law essay help
best website to get essays <a href=https://customessaywwriting.com>best essay writing service online</a> essay editing service reviews
essays services <a href=https://customessays-writing.org>essay checking service</a> do my essay for cheap